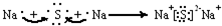题目内容
5.下列反应可以使碳链增长的是( )| A. | CH3CH2CH2CH2Br和NaCN共热 | |
| B. | CH3CH2CH2CH2Br和NaOH的乙醇溶液共热 | |
| C. | CH3CH2CH2CH2Br和NaOH的水溶液共热 | |
| D. | CH3CH2CH2CH2Br(g)和Br2(g)光照 |
分析 A、CH3CH2CH2CH2Br和NaCN共热,-C≡N取代-Br,碳链增长;
B、醇类消去反应,碳链长度不变;
C、醇类的取代反应,碳链长度不变;
D、卤代烃的取代反应,不能增长碳链.
解答 解:A、CH3CH2CH2CH2Br和NaCN共热,反应生成CH3CH2CH2CH2CN,增加了一个碳原子,故A正确;
B、CH3CH2CH2CH2Br和NaOH的乙醇溶液共热,生成CH3CH2CH=CH2,碳的个数不变,故B错误;
C、CH3CH2CH2CH2Br和NaOH的水溶液共热,生成CH3CH2CH2CH2OH,碳的个数不变,故C错误;
D、卤代烃光照条件下发生取代反应,Br取代H的位置,碳的个数不变,故D错误;
故选A.
点评 本题主要考查的是常见有机化学反应类型以及反应原理,判断有无碳个数的变化是解决本题的关键,难度不大.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
16.实验室中,下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.lmol•L-1甲溶液的pH为13(25℃),Y元素最低负化合价的绝对值与其原子最外层电子数相等,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
20.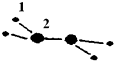 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.
(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:从平衡表达式可以看出,当c(NH3•H2O)、c(Mg2+)改变相同的程度,c2(NH3•H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH-)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH-)<Ksp[Mg(OH)2].
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v=k[I-]1[ClO-]b[OH-]c(温度一定时,k为常数).
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
14.H、C、N、O、都属于自然界中常见非金属元素.
(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
结合数据说明CO比N2活泼的原因CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂.
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.
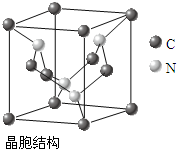
(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.

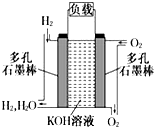 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: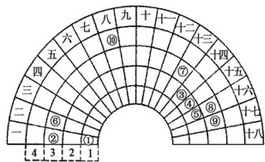 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题