题目内容
1.标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )| A. | H2与C2H4 | B. | CO与C2H4 | C. | H2与C4H6 | D. | CO 与C3H6 |
分析 碳酸钙物质的量为:$\frac{15g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,两种可燃气体总物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,故该混合气体平均分子式为C2H4或C2H4Ox,据此结合各选项进行判断.
解答 解:碳酸钙物质的量为:$\frac{15g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,两种可燃气体总物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,故该混合气体平均分子式为C2H4或C2H4Ox,
A.H2与C2H4等物质的量混合,平均分子式为CH3,不符合题意,故A错误;
B.CO与C2H4等物质的量混合,平均分子式为C1.5H2O0.5,不符合题意,故B错误;
C.C4H6、H2等物质的量混合,平均分子式为C2H4,符合题意,故C正确;
C.C3H6、CO等物质的量混合,平均分子式为C2H3O0.5,不符合题意,故D错误;
故选C.
点评 本题考查有机物分子式的确定,题目难度中等,注意明确平均分子式法在确定有机物分子式中的应用,试题侧重考查学生的分析能力及化学计算能力.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
| A. | 不能发生氧化反应 | B. | 属于芳香族化合物 | ||
| C. | 能发生消去反应 | D. | 分子中含有11个碳碳双键 |
| A. | Cl- | B. | CO32- | C. | HCO3- | D. | AlO2- |
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 | |
| C. | 将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 | |
| D. | 用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 苯的分子式C6H6 | D. | 四氯化碳的电子式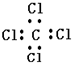 |
| A. | NaOH是离子化合物不含共价键 | B. | CO2分子中含有非极性键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
| A. | 相同条件下,NA个CO2分子和NA个H2O分子的体积一定相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中Na+的物质的量浓度为1mol/L | |
| C. | 电解58.5g熔融的NaCl能产生22.4L氯气(标准状况)和23.0g金属钠 | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子书为0.1NA |
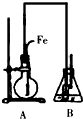 某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下: