题目内容
11.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 相同条件下,NA个CO2分子和NA个H2O分子的体积一定相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中Na+的物质的量浓度为1mol/L | |
| C. | 电解58.5g熔融的NaCl能产生22.4L氯气(标准状况)和23.0g金属钠 | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子书为0.1NA |
分析 A、相同条件下,气体摩尔体积相同,但水可能为液态;
B、溶液的体积不等同于溶剂的体积;
C、求出氯化钠的物质的量,然后根据电解1mol氯化钠生成0.5mol氯气来分析;
D、求出钠的物质的量,然后根据1mol钠在反应时失去1mol电子来分析.
解答 解:A、相同条件下,气体摩尔体积相同,但水可能为液态,故NA个CO2分子和NA个H2O分子的物质的量虽然均为1mol,但体积不一定相同,故A错误;
B、溶液的体积不等同于溶剂的体积,当将含NA个Na+的Na2O溶解于1L水时,溶液的体积大于1L,则Na+的物质的量浓度小于1mol/L,故B错误;
C、NaCl的物质的量为$\frac{58.5g}{58.5g/mol}$=1mol,则电解58.5g熔融的NaCl,能产生0.5mol×22.4L/mol=11.2L氯气(标准状况),而不是22.4L氯气,故C错误;
D、2.3g钠的物质的量为0.1mol,而钠在反应后,由0价变为+1价,即1mol钠失去1mol电子,则0.1mol钠失去0.1mol电子,即0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )
| A. | H2与C2H4 | B. | CO与C2H4 | C. | H2与C4H6 | D. | CO 与C3H6 |
2.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 62gNa2O溶于水后所得溶液中含有的O2-数为NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA | |
| D. | 0.1 mol FeCl3滴入沸水形成的 胶体粒子的 数目为0.1NA |
19.下列对于二氯二溴甲烷(CCl2Br2 )的认识正确的是( )
| A. | 只有一种结构 | B. | 有两种同分异构体 | ||
| C. | 属于烷烃 | D. | 属于正四面体结构 |
6.下列有关电解质溶液中离子浓度关系的叙述中正确的是( )
| A. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中,c(Fe2+)+c(NH4+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 等体积等物质的量浓度的Na2CO3和NaHCO3溶液混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) | |
| C. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的NaOH溶液等体积混合:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | |
| D. | PH相同的CH3COONa溶液、NaHCO3溶液、NaOH溶液:c(NaHCO3)>c(CH3COONa)>c(NaOH) |
9.下列关于物质性质的叙述中,正确的是( )
| A. | 硫是一种淡黄色的难溶于水的晶体,既有氧化性又有还原性 | |
| B. | NO2溶于水生成硝酸,所以NO2是酸性氧化物 | |
| C. | Cl2能在常温下与金属活动性顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质不活泼,在自然界中有游离态存在 |
10.${\;}_{27}^{60}$Co是γ射线放射源,可用于农作物诱变育种,我国用该方法培育出了许多农作物新品种,对${\;}_{27}^{60}$Co原子的叙述不正确的是( )
| A. | 中子数是33 | B. | 质量数是60 | C. | 质子数是60 | D. | 电子数是27 |
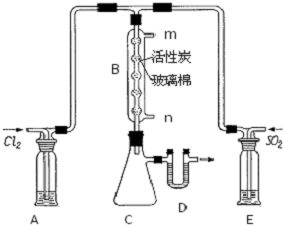 磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾.
磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾.