题目内容
6.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
分析 (1)①Ti为22号元素,原子核外有22个电子,失去3个电子形成Ti3+,基态Ti3+的核外电子排布式为1s22s22p63s23p63d1;
②计算B原子价层电子对确定杂化方式;
(2)①电子层结构相同的离子,其离子半径随着核电荷数的增大而减小;
②M元素的第三电离能剧增,则该元素原子最外层有2个电子,由于存在第五电离能,故其核外电子数大于4,故M为Mg.
解答 解:(1)①Ti为22号元素,原子核外有22个电子,失去3个电子形成Ti3+,基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5,故答案为:19;3d;5;
②BH4-中B原子价层电子数=4+$\frac{3+1-1×4}{2}$=4,且不含孤电子对,B原子采取sp3杂化,故答案为:sp3杂化;
(2)①Li+和H-的电子层结构相同,锂元素的核电荷数大于氢元素,所以离子半径Li+<H-,故答案为:<;
②M元素的第三电离能剧增,则该元素原子最外层有2个电子,由于存在第五电离能,故其核外电子数大于4,故M为Mg,则该氢化物化学式为MgH2,故答案为:MgH2.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、微粒半径比较、电离能,难度不大,注意理解电离能与原子结构、化合价关系.

练习册系列答案
相关题目
14.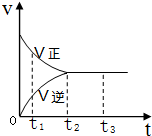 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
 在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )
在一密闭容器中放入1mol X,进行可逆反应2X(g)?3Y(g),反应过程中的反应速率(v)与时间(t)的变化关系如图所示,下列叙述正确的是( )| A. | t1时,只有正反应在进行 | |
| B. | t2~t3时间段,反应停止 | |
| C. | t2时,容器内有1.5mol Y | |
| D. | t2~t3时间段,X,Y的物质的量均没有发生变化 |
1.标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )
| A. | H2与C2H4 | B. | CO与C2H4 | C. | H2与C4H6 | D. | CO 与C3H6 |
11.化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ•mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量.一个化学反应一般都有旧化学键的破坏和新化学键的形成.
下表是一些键能数据(KJ•mol-1):
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
18.下列物质的类别与所含官能团都正确的是( )
| A. | 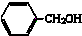 酚类-OH 酚类-OH | B. | 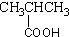 羧酸-CHO 羧酸-CHO | C. |  醛类-CHO 醛类-CHO | D. | CH3-O-CH3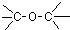 |
15.根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )
| A. | 固体氯化钠溶于水 | B. | 氯化氢溶于水 | ||
| C. | 冰经加热变成水蒸气 | D. | 氯化铵受热分解生成氯化氢和氨气 |
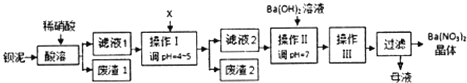
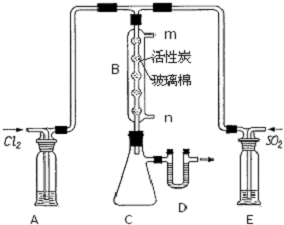 磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾.
磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾.