题目内容
10.下列说法正确的是( )| A. | NaOH是离子化合物不含共价键 | B. | CO2分子中含有非极性键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
分析 A.NaOH中含O-H共价键;
B.CO2分子结构为O=C=O;
C.12C、13C、14C的质子数均为6,中子数不同;
D.16O、17O、18O的质子数均为8,中子数不同.
解答 解:A.NaOH中含O-H共价键,NaOH是含离子键和共价键的离子化合物,故A错误;
B.CO2分子结构为O=C=O,只含C、O之间的极性共价键,故B错误;
C.12C、13C、14C的质子数均为6,中子数不同,是碳的三种核素,故C正确;
D.16O、17O、18O的质子数均为8,中子数分别为8、9、10,故D错误;
故选C.
点评 本题考查较综合,涉及化学键、核素及原子中的数量关系等,为高频考点,把握化学键的性质、原子构成等为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
1.标准状况下两种等物质的量的可燃气体共1.68L,其中一种是烃,在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.则这两种混合气体可能为( )
| A. | H2与C2H4 | B. | CO与C2H4 | C. | H2与C4H6 | D. | CO 与C3H6 |
18.下列物质的类别与所含官能团都正确的是( )
| A. | 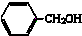 酚类-OH 酚类-OH | B. | 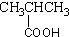 羧酸-CHO 羧酸-CHO | C. |  醛类-CHO 醛类-CHO | D. | CH3-O-CH3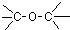 |
15.根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )
| A. | 固体氯化钠溶于水 | B. | 氯化氢溶于水 | ||
| C. | 冰经加热变成水蒸气 | D. | 氯化铵受热分解生成氯化氢和氨气 |
2.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 62gNa2O溶于水后所得溶液中含有的O2-数为NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA | |
| D. | 0.1 mol FeCl3滴入沸水形成的 胶体粒子的 数目为0.1NA |
19.下列对于二氯二溴甲烷(CCl2Br2 )的认识正确的是( )
| A. | 只有一种结构 | B. | 有两种同分异构体 | ||
| C. | 属于烷烃 | D. | 属于正四面体结构 |
9.下列关于物质性质的叙述中,正确的是( )
| A. | 硫是一种淡黄色的难溶于水的晶体,既有氧化性又有还原性 | |
| B. | NO2溶于水生成硝酸,所以NO2是酸性氧化物 | |
| C. | Cl2能在常温下与金属活动性顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质不活泼,在自然界中有游离态存在 |
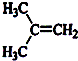
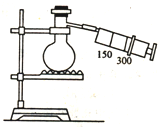 如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答:
如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答: