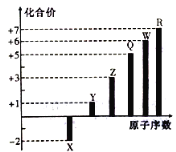
题目内容
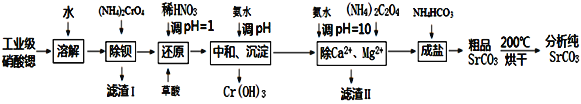
【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
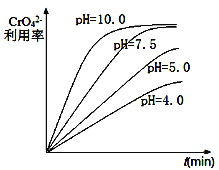
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。
【答案】pH过低CrO42-的利用率低,pH=7.5和pH=10时CrO42-的利用率相当,但后期需要将pH值调回1.0,导致浪费药品,因此应选用pH=7.5 8H++Cr2O72-+3H2C2O4=6CO2↑+2Cr3++7H2O CaC2O4和Mg(OH)2 NH3·H2O+HCO3-+Sr2+=SrCO3↓+NH4++H2O NH4NO3 4.3 6
【解析】
硝酸锶用水溶解,加入重铬酸铵除钡得到BaCr2O7沉淀,过滤分离,滤液中加入硝酸、草酸还原Cr2O72-,再加入氨水中和、沉淀得到Cr(OH)3,可知Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,再过滤分离,滤液中加入氨水、醋酸铵、硫化氢,除去Ca2+、Mg2+、重金属,滤液中再加入碳酸氢铵得到碳酸锶,滤液中含有Sr2+,进行循环利用。
(1) pH过低 CrO42-的利用率低,pH=7.5和pH=10时CrO42-的利用率相当,但后期需要将pH调回1,导致浪费药品,因此应选用pH=7.5;
(2)步骤②是酸性条件下Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,反应离子方程式为:3H2C2O4+8H++Cr2O72-=2Cr3++6CO2↑+7H2O,故答案为:3H2C2O4+8H++Cr2O72-=2Cr3++6CO2↑+7H2O;
(3)调pH为10是为了除去Ca2+和Mg2+,此时加入了草酸铵,由溶解度表可知MgC2O4的Ksp大于Mg(OH)2的Ksp,Ca(OH)2的Ksp大于CaC2O4,有沉淀转化关系可知,沉淀最终会转化成溶解度更小的沉淀,故“滤渣Ⅱ”的主要成分为CaC2O4和Mg(OH)2;
(4) NH3·H2O在溶液中发生电离,产生氢氧根离子,氢氧根离子和HCO3-反应生成CO32-,最终生成SrCO3沉淀,离子方程式为:NH3·H2O+HCO3-+Sr2+=SrCO3↓+NH4++H2O;
(5) 由于对产品的纯度要求是分析纯,而在成盐过程中生成的SrCO3经过滤和洗涤后,仍会含微量NH4NO3,因此需要在200 ℃时烘干使铵盐分解;
(6)起始n(Cr3+)=0.1mol/L,开始沉淀时Ksp= ![]() ,c(OH-)=
,c(OH-)= 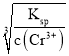 =
= ![]() =
= ![]() mol/L,pH=-lg
mol/L,pH=-lg 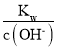 =-lg
=-lg ![]() =
= ![]() =4.3;当Cr3+除尽时,n(Cr3+)=10-6mol/L,此时c(OH-)=
=4.3;当Cr3+除尽时,n(Cr3+)=10-6mol/L,此时c(OH-)= 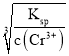 =
= ![]() =
= ![]() mol/L,pH=-lg
mol/L,pH=-lg 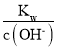 =-lg
=-lg ![]() =6。
=6。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
则CO2与H2反应合成二甲醚生成液态水的热化学方程式为:____________________。
(2)工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
(3)若反应2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比较该时刻正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,经10 min反应达到平衡,则平衡后c(CH3OH)=______________,
该时间内反应速率v(CH3OCH3)=_____________。
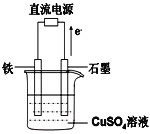
(4)利用二甲醚(CH3OCH3)设计一个燃料电池,用KOH溶液作电解质溶液,石墨做电极,该电池负极电极反应式为___________________________。以此燃料电池作为外接电源按如图所示电解硫酸铜溶液,如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______其质量约为_____g。
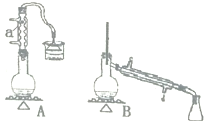
【题目】实验室用加热1一丁醇、浓H2SO4和溴化钠混合物的方法来制备1一溴丁烷,设计了如图所示的实验装置![]() 其中的夹持仪器已省略
其中的夹持仪器已省略![]() 。
。
已知:H2SO4+NaBr=NaHSO4+HBr, H2SO4(浓)+2HBr=Br2+SO2↑+2H2O
请回答下列问题:
(1)仪器a的名称为______。
(2)制备操作中,加入的浓硫酸事先要进行稀释,其目的是______![]() 填选项字母
填选项字母![]() 。
。
![]() 减少副产物烯和醚的生成
减少副产物烯和醚的生成![]() 减少
减少![]() 的生成
的生成![]() 水是反应的催化剂
水是反应的催化剂
(3)写出此实验制1一溴丁烷的总化学方程式______。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“![]() ”,来确定副产物中是否存在丁醚
”,来确定副产物中是否存在丁醚![]() 请评价该同学设计的鉴定方案是否合理?理由是______。
请评价该同学设计的鉴定方案是否合理?理由是______。
(5)为了进一步提纯1一溴丁烷,该小组同学查得相关有机物的有关数据如表:
物质 | 熔点 | 沸点 |
1一丁醇 |
|
|
1一溴丁烷 |
|
|
丁醚 |
|
|
1一丁烯 |
|
|
则用B装置完成此提纯实验时;,实验中要迅速升高温度至______收集所得馏分。
(6)若实验中所取1一丁醇、NaBr分别为![]() 、
、![]() ,浓硫酸
,浓硫酸![]() ,蒸出的粗产物经洗涤,干燥后再次蒸馏得到
,蒸出的粗产物经洗涤,干燥后再次蒸馏得到![]() 一溴丁烷,则1一溴丁烷的产率是______
一溴丁烷,则1一溴丁烷的产率是______![]() 保留2位有效数字
保留2位有效数字![]() 。
。
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D