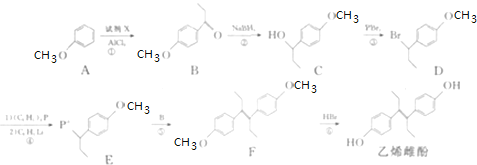
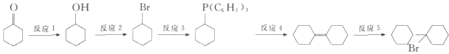
题目内容
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示。下列说法正确的是
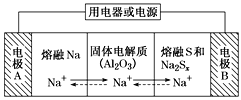
A.放电时,电极A为正极
B.充电时,Na+ 从电极A向电极B迁移
C.充电时,电极B反应式为S22-- 2e- === xS
D.该电池工作的适宜温度应控制在25 ℃左右
【答案】C
【解析】
A. 放电时,熔融Na发生氧化反应,电极A为负极,A项错误;
B. 充电时,电极A为阴极,电极B为阳极,电解池中阳离子从阳极向阴极迁移,B项错误;
C. 充电时,阳极上Sx2-失电子,发生氧化反应,电极反应式为Sx2--2e-=xS,C项正确;
D. 该电池以熔融金属钠、熔融硫和多硫化钠分别作为两个电极的反应物,因此该电池工作时应保证Na、S均为熔融状态,而25 ℃左右时Na、S均为固态,D项错误;
正确答案是C。

【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
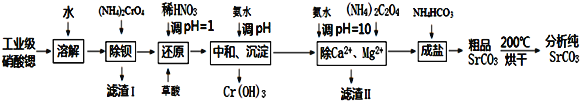
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
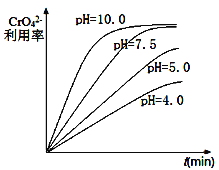
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。