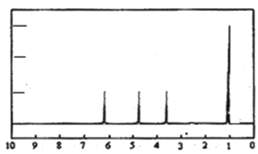
题目内容
【题目】短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如图所示。下列说法正确的是
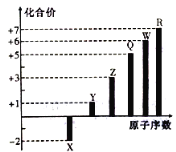
A.X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X
B.Q元素形成的可溶性盐的溶液不可能显酸性
C.X、Y、R形成的某种化合物可以用于漂白、消毒
D.Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应
【答案】C
【解析】
短周期元素X、Y、Z、Q、W、R,且原子序数依次增大,通过图像可知,X只有-2价,可确定为O元素;Y、Z、Q、W、R,则为第三周期元素,Y化合价为+1,为Na元素;Z化合价+3为Al;Q最高化合价为+5为P元素;W为S元素;R为Cl元素。
A. X、Y、Z的离子具有相同的核外电子排布,且核外有2个电子层;W、R的离子具有相同的核外电子排布,且核外有3个电子层。具有相同的核外电子排布的离子,原子序数越大,半径越小;电子层数越多,半径越大,可知简单离子半径大小顺序为W>R>X>Y>Z,A不正确;
B.P元素形成的NaH2PO4,溶液显酸性,B错误;
C. X、Y、R形成的化合物中,NaClO可用作杀菌消毒的试剂,C正确;
D.Na、Al、S的最高价氧化物对应的水化物分别为NaOH、Al(OH)3、H2SO4.Al(OH)3为两性氢氧化物,既能与酸反应,又能与强碱反应,可两两反应,D错误;
答案为C

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
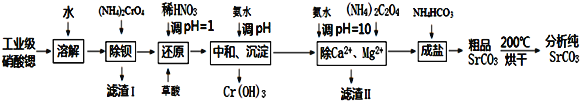
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
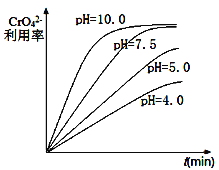
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。