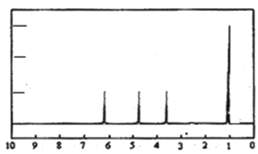
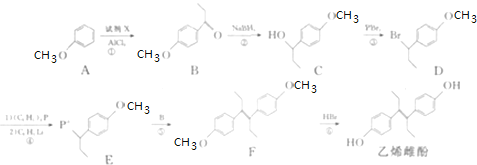
题目内容
【题目】甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
则CO2与H2反应合成二甲醚生成液态水的热化学方程式为:____________________。
(2)工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
(3)若反应2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比较该时刻正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,经10 min反应达到平衡,则平衡后c(CH3OH)=______________,
该时间内反应速率v(CH3OCH3)=_____________。
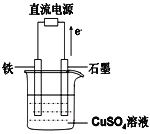
(4)利用二甲醚(CH3OCH3)设计一个燃料电池,用KOH溶液作电解质溶液,石墨做电极,该电池负极电极反应式为___________________________。以此燃料电池作为外接电源按如图所示电解硫酸铜溶液,如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______其质量约为_____g。
【答案】2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(l)△H=-253.5kJmol-1 BC > 0.04molL-1 0.08molL-1min-1 CH3OCH3-12e-+16OH-=2CO32-+11H2O CuO 4g
【解析】
(1)根据盖斯定律分析作答;
(2)变量不变时,可以说明反应达到平衡状态;
(3)①根据各组分的浓度商与平衡常数的大小进行判断反应方向及正逆反应速率大小;
②设达到平衡时又消耗了xmol甲醇,利用三段式及平衡常数列出方程式进行计算平衡时甲醇浓度及二甲醚的反应速率;
(4)燃料电池中,负极上是燃料甲醚发生失电子的氧化反应,正极反应为氧气得到电子发生还原反应,在碱性环境中生成氢氧根离子;电解池中,根据电解原理反应,结合电子转移数相等找出关系式分析计算。
(1)已知①CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
②2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
③H2O(l)=H2O(g) △H= + 44 kJ·mol-1
根据盖斯定律①×2+②-③×3得出CO2与H2反应合成二甲醚生成液态水的热化学方程式为2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(l)△H=-253.5kJmol-1,故答案为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(l)△H=-253.5kJmol-1;
(2)A.v正(H2)=2v逆(CH3OH),表示的是正逆反应速率,且满足二者计算量关系,说明反应达到平衡状态,故A错误;
B.n(CO):n(H2):n(CH3OH)=1:2:1,物质的量之比,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故B正确;
C.混合气体的密度不变,反应前后都是气体,容器的容积不变,所以气体的密度始终不变,密度不能作为判断平衡状态的依据,故C正确;
D.该反应是气体体积缩小的反应,反应过程中气体的物质的量发生变化,混合气体的平均分子量发生变化,若混合气体的平均相对分子质量不变,说明达到了平衡状态,故D错误;
E.该反应是体积缩小的反应,气体的物质的量在反应中发生变化,若容器的压强不变,说明正逆反应速率相等,达到了平衡状态,故E错误;
故答案为:BC;
(3)①此时的浓度商为:Qc= ![]() =1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,故答案为:>;
=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,故答案为:>;
②设达到平衡时据此又消耗了xmol,则
 则K=
则K= ![]() =400,解得x=0.2mol/L,故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,则10min生成二甲醚的浓度为:0.6mol/L+0.2moL/L=0.8mol/L,
=400,解得x=0.2mol/L,故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,则10min生成二甲醚的浓度为:0.6mol/L+0.2moL/L=0.8mol/L,
所以甲醇的反应速率为v(CH3OH)= ![]() =0.08mol/(Lmin),
=0.08mol/(Lmin),
故答案为:0.04molL-1;0.08molL-1min-1;
(4)燃料电池中,负极上是燃料甲醚发生失电子的氧化反应,在碱性环境下,即为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,正极反应为氧气得到电子发生还原反应,在碱性环境中生成氢氧根离子,正极反应为3O2+12e-+6H2O=12OH-。
下半部分为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阴极反应式:Cu2+ +2e-==Cu 阳极反应式:4OH- -4e-==2H2O+O2↑,从体系中脱离的是Cu和O,且原子比例为1:1,所以向溶液中加入CuO,pH=1时H+浓度为0.1mol/L,溶液体积为1L,故H+的物质的量为0.1mol,因为反应前H+较少,可以认为0.1molH+全部来自于电解2H2O-4e-=O2+4H+,故产生0.1molH+就会产生0.25molO2,含有0.05molO原子,根据原子守恒,需要补充0.05mol CuO,CuO的质量为0.05mol×80g/mol= 4g。
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;CuO;4g。

【题目】某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 27.45 |
第二次 | 25.00 | 0.00 | 30.30 |
第三次 | 25.00 | 0.00 | 27.55 |
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗
【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
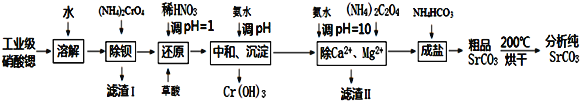
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
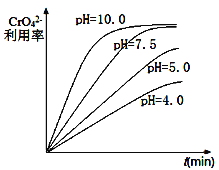
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。