题目内容
9.某结晶水合物的化学式为R•xH2O其相对分子质量为Mr,在25℃时a g晶体溶于b g水中,恰好达饱和,形成V mL溶液,则下列表达式中不正确的是( )| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
分析 根据结晶水合物的相对分子质量和质量可求解物质的量,根据C=$\frac{n}{V}$、质量分数=$\frac{溶质质量}{溶液质量}$、溶解度等于100g水中溶解溶质的质量、$ρ=\frac{m}{V}$进行有关计算.
解答 解:A.溶质的物质的量=$\frac{a}{Mr}$momol,溶液的物质的量浓度为:$\frac{\frac{a}{Mr}}{V×1{0}^{-3}}$=$\frac{1{0}^{3}a}{MrV}$,故A错误;
B.溶质的质量=a×$\frac{Mr-18x}{Mr}$=$\frac{a(Mr-18x)}{Mr}$g,所以饱和溶液的质量分数=$\frac{a(Mr-18x)}{(a+b)Mr}$,故B正确;
C.溶质的质量=a×$\frac{Mr-18x}{Mr}$=$\frac{a(Mr-18x)}{Mr}$g,溶剂的质量=$\frac{18xa}{Mr}$+bg,所以其溶解度=$\frac{100×\frac{a(Mr-18x)}{Mr}}{\frac{18ax}{Mr}+b}$=$\frac{100a(Mr-18x)}{(bMr+18ax)}$g,故C正确;
D.溶液的质量=(a+b)g,溶液的密度=$\frac{a+b}{V}$g/mL,故D正确;
故选A.
点评 本题考查物质的有关计算,明确公式表达式是解本题关键,难度较大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
20.下列物质分类正确的是( )
| A. | 非电解质:NH3 | B. | 氧化物:H2C2O4 | ||
| C. | 混合物:KAl(SO4)2•12H2O | D. | 强酸:HClO |
4.化学是一门以实验为基础的学科,弄清实验原理和细致观察实验现象是一种重要的能力.
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
(1)该实验采用了单一变量法,其中,实验①④对比是为了探究K+是否对反应速率有影响,实验①②对比是为了探究温度是否对反应速率有影响.
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
14.下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别的是( )
| A. | NaOH、CuSO4、HCl、KNO3 | B. | HCl、KOH、NaCl、Na2SO4 | ||
| C. | Ca(OH)2、Na2CO3、NaCl、HCl | D. | NaNO3、MgCl2、KCl、Ba(OH)2 |
11.反应2SO2+O2?2SO3达到平衡后,再向反应容器中充入含氧的同位素的氧气,经过一段时间后,原子存在于( )
| A. | O2 | B. | SO2 | C. | O2和SO2 | D. | O2、SO2和SO3 |
12.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.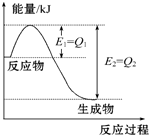 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1. 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置: