题目内容
17.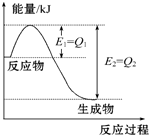 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
分析 由图2求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写解答.
解答 解:由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(Q1-Q2)kJ•mol-1,
故答案为:N2 (g)+3H2(g)═2NH3(g)△H=2(Q1-Q2) kJ•mol-1.
点评 本题考查了热化学方程式书写方法,图象分析判断,反应焓变的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
8.用0.01mol/L硫酸滴定0.01mol/L烧碱溶液,中和后加水至100mL.若滴定至终点时判断有误,甲多加了一滴硫酸,而乙则少加了一滴硫酸(20滴为1mL),则甲和乙最终c(H+)的比值为( )
| A. | 10 | B. | 50 | C. | 5×103 | D. | 1×104 |
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )
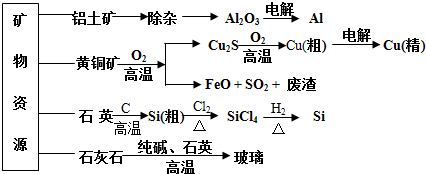

| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
2.某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(1)帮助该组同学完成以上实验设计表.
(2)该小组同学在对比①和⑤实验时发现①的反应速度都明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?Cl-能够促进Al与H+的反应或SO42-对Al与H+的反应起阻碍作用.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(1)帮助该组同学完成以上实验设计表.
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
9.某结晶水合物的化学式为R•xH2O其相对分子质量为Mr,在25℃时a g晶体溶于b g水中,恰好达饱和,形成V mL溶液,则下列表达式中不正确的是( )
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
6.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
 .
.
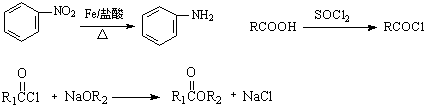
 ,G
,G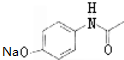 .
. .
. .
. 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)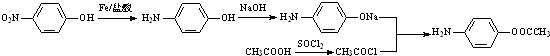 .
.