题目内容
20.下列物质分类正确的是( )| A. | 非电解质:NH3 | B. | 氧化物:H2C2O4 | ||
| C. | 混合物:KAl(SO4)2•12H2O | D. | 强酸:HClO |
分析 A、水溶液中和熔融状态都不导电的化合物为非电解质;
B、两种元素组成,其中一种元素为氧元素的化合物为氧化物;
C、不同物质组成的为混合物;
D、水溶液中全部电离的酸为强酸.
解答 解:A、氨气水溶液中和熔融状态都不导电,属于非电解质,故A正确;
B、H2C2O4由三种元素组成,不是氧化物,故B错误;
C、KAl(SO4)2•12H2O是结晶水合物属于纯净物,不是混合物,故C错误;
D、HClO为弱酸存在电离平衡,不是强酸,故D错误;
故选A.
点评 本题考查了物质分类方法,非电解质概念的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
10.下列反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 2NH3.H2O+SO2═2NH4++SO32-+H2O | |
| D. | 硝酸铁溶液中加过量氨水 Fe3++3NH3.H2O═Fe(OH)3↓+3NH4+ |
8.用0.01mol/L硫酸滴定0.01mol/L烧碱溶液,中和后加水至100mL.若滴定至终点时判断有误,甲多加了一滴硫酸,而乙则少加了一滴硫酸(20滴为1mL),则甲和乙最终c(H+)的比值为( )
| A. | 10 | B. | 50 | C. | 5×103 | D. | 1×104 |
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )
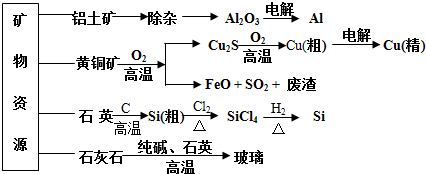

| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
9.某结晶水合物的化学式为R•xH2O其相对分子质量为Mr,在25℃时a g晶体溶于b g水中,恰好达饱和,形成V mL溶液,则下列表达式中不正确的是( )
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
3.下列叙述中正确的是( )
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
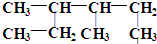 的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.
的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.
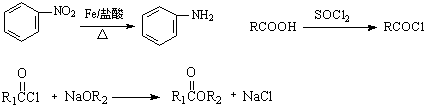
 ,G
,G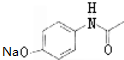 .
. .
. .
. 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)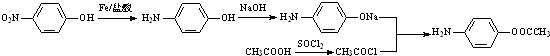 .
.