题目内容
4.化学是一门以实验为基础的学科,弄清实验原理和细致观察实验现象是一种重要的能力.Ⅰ.某同学利用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液探究溶液出现蓝色的时间与温度的关系.
(1)用离子方程式解释实验原理4H++4I-+O2=2I2+2H2O
(2)实验时,试剂加入顺序为①KI溶液、②淀粉溶液、③稀H2SO4溶液,试解释②③的顺序为何不能颠倒若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝).
Ⅱ.某化学小组发现草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,为了探究其主要原因,进行了如下实验:
【实验原理】5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O
【探究记录及分析】
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |
(2)x=25
(3)不能(填“能”、“不能”)用MnCl2固体代替MnSO4固体.
【探究结论】
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但随后查阅已有的文献资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.

结合文献资料与实验得出:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
分析 I.(1)碘离子具有较强还原性,容易被氧气氧化成碘单质,据此写出反应的离子方程式;
(2)②③的顺序若颠倒,无法及时测定出碘单质是否生成;
II.(1)实验①②中,除温度以外,其它条件都完全相同,则探究的是温度对反应速率的影响;
(2)实验①④对比是为了探究K+是否对反应速率有影响,则溶液总体积必须完全相同;
(3)酸性条件下氯离子能够被酸性高锰酸钾溶液氧化成氯气;
(4)根据图2可知,反应中生成的MnSO4(Mn2+)对该反应有催化作用.
解答 解:I.(1)碘离子在酸性条件下能够被氧气氧化成碘单质,反应的离子方程式为:4H++4I-+O2=2I2+2H2O,
故答案为:4H++4I-+O2=2I2+2H2O;
(2)由于②③顺序颠倒,生成的I2不能立刻被检测到,所以②淀粉溶液、③稀H2SO4溶液的顺序不能颠倒,
故答案为:若②③顺序颠倒,则I2生成后不能立刻被检测到(溶液变蓝);
II.(1)除温度不同外,实验①②的其它条件都完全相同,且反应速率不相等,说明实验目的是探究温度是否对反应速率有影响,
故答案为:探究温度是否对反应速率有影响;
(2)实验①④对比是为了探究K+是否对反应速率有影响,必须满足两个实验的总体积相等,实验④中加入了5mL硫酸钾溶液,则加入的水的体积必须比实验①小5mL,则x=30-5-25,
故答案为:25;
(3)由于在酸性条件下氯离子能够被酸性高锰酸钾溶液氧化成氯气,所以不能用MnCl2固体代替MnSO4固体,
故答案为:不能;
(4)根据图1可知,反应过程中溶液中锰离子浓度逐渐增大,根据图2可知,锰离子浓度对反应速率有影响,所以草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是:反应生成的MnSO4(Mn2+)对该反应有催化作用,
故答案为:草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,生成的MnSO4(Mn2+)对该反应有催化作用.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,明确温度、催化剂、浓度等因素对化学反应速率的影响为解答关键,注意掌握对照试验的设计原则,试题培养了学生的分析、归纳能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | HCl、HBr、HI的熔点沸点升高与范德华力大小有关 | |
| B. | H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 甲烷与水分子间不能形成氢键这种化学键 |
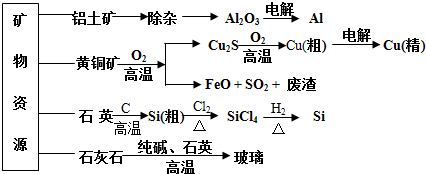
| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
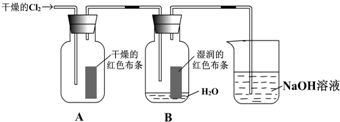
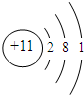 ;
;