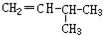题目内容
12.下列离子方程式正确的是( )| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
分析 A.乙酸为弱电解质,保留化学式;
B.醋酸铜为可溶性盐,拆成离子形式;
C.苯酚钠溶液中通入少量二氧化碳反应生成碳酸氢钠;
D.醛溶液与足量的银氨溶液共热发生氧化反应,生成醋酸铵、银、氨气和水.
解答 解:A.乙酸与碳酸钠溶液反应:2CH3COOH+CO32-═CO2↑+H2O+2CH3COO-,故A错误;
B.醋酸溶液与新制氢氧化铜反应,离子方程式:2CH3COOH+Cu(OH)2→2CH3COO-+Cu2++2 H2O,故B错误;
C.苯酚钠溶液中通入少量二氧化碳,离子方程式:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D.乙醛溶液与足量的银氨溶液共热,离子方程式:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意苯酚钠与碳酸反应的产物,题目难度不大.

练习册系列答案
相关题目
9.某结晶水合物的化学式为R•xH2O其相对分子质量为Mr,在25℃时a g晶体溶于b g水中,恰好达饱和,形成V mL溶液,则下列表达式中不正确的是( )
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
3.下列叙述中正确的是( )
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
1.下列物质中属于同素异形体的是( )
| A. | H2O和H2O2 | B. | 12C和14C | C. | O2和O3 | D. | SO2和SO3 |
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18g(H218O)含有的原子总数为3NA | |
| B. | 标准状况下,4.2g CH2=CH2气体中所含有的碳原子总数为0.3NA | |
| C. | 将0.1mol的Cl2通入1L水中转移的电子数目为0.1NA | |
| D. | 0.1mol/LAl2(SO4)3溶液中含有的Al3+总数为0.2NA |

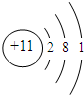 ;
;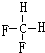 和
和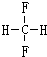
 和CH2=CH-CH2
和CH2=CH-CH2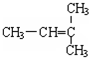 和
和