题目内容
1. 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:回答下列问题:
装置甲中正极材料是Al
其电极反应式为2H++2e-=H2↑
装置乙中负极材料是Al,
其电极反应式为Al+4OH--3e-=AlO2-+2H2O
(2)甲、乙两位同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出Mg活动性更强,而乙会判断出Al活动性更强.(填元素符号)
(3)由此实验,你认为下列结论中正确的是AD(填字母).
A.利用原电池原理判断金属活动性强弱时应注意选择合适的介质
B.镁的金属活动性不一定比铝的金属活动性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析.
分析 (1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(2)根据作负极的金属活泼性强结合电池中的负极判断;
(3)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析.
解答 解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,
乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为Al+4OH--3e-=AlO2-+2H2O,故答案为:Al;2H++2e-=H2↑;Al;Al+4OH--3e-=AlO2-+2H2O;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故错误;
C.该实验对研究物质的性质有实用价值,故错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故正确;
故答案为:AD.
点评 本题考查金属活泼性及探究原电池原理,为高频考点,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极为易错点,题目难度中等.

练习册系列答案
相关题目
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )
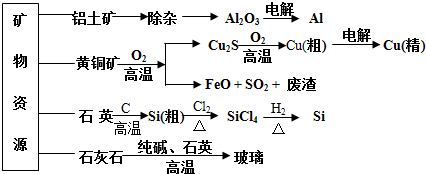

| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
9.某结晶水合物的化学式为R•xH2O其相对分子质量为Mr,在25℃时a g晶体溶于b g水中,恰好达饱和,形成V mL溶液,则下列表达式中不正确的是( )
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
16.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
6.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
3.下列叙述中正确的是( )
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
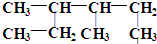 的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.
的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.