题目内容
3.25℃时,下列各溶液中关系的叙述中,正确的是( )| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 等物质的量浓度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,则BA(盐)溶液pH<7 | |
| D. | 4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.氢离子抑制铵根离子水解、碳酸氢根离子促进铵根离子水解,水解程度越大,铵根离子浓度越小;
C.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,说明HA是弱电解质、BOH是强电解质,BA是强碱弱酸盐,其溶液呈碱性;
D.NaOH是强碱,pH相同的这几种溶液中c(Na+)最小,相同pH的弱酸的钠盐溶液中,酸根离子水解程度越大c(Na+)越小.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c (Na+)+c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.氢离子抑制铵根离子水解、碳酸氢根离子促进铵根离子水解,水解程度越大,铵根离子浓度越小,所以等物质的量浓度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3,故B正确;
C.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,说明HA是弱电解质、BOH是强电解质,BA是强碱弱酸盐,A-水解导致其水溶液呈碱性,pH>7,故C错误;
D.NaOH是强碱,pH相同的这几种溶液中c(Na+)最小,相同pH的弱酸的钠盐溶液中,酸根离子水解程度越大c(Na+)越小,酸根离子水解程度C6H5O->HCO3->CH2COO-,所以这几种溶液中c(Na+)的大小顺序①>③>②>④,故D错误;
故选AB.
点评 本题考查离子浓度大小比较,涉及盐类水解、弱电解质的电离等知识点,明确溶液中的溶质及其性质是解本题关键,易错选项是D,注意水解程度:CO32->C6H5O->HCO3-,题目难度不大.

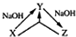 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 还原性:HCl、HBr、HI | ||
| C. | 酸性:HClO4、H2SO4、H3PO4 | D. | 稳定性:HI、HBr、HCl |
| A. | C2H4 | B. | CaCl2 | C. | Na2O2 | D. | NH4NO3 |
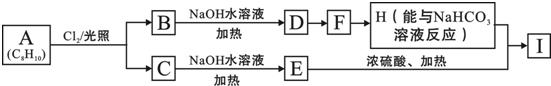
 .
. .
.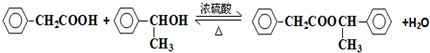 .
.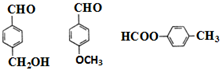 (其中两种).
(其中两种).

 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子) .经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为
.经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为 .
.