题目内容
1.铜跟稀硝酸反应,如果有1mol硝酸被还原了,则被氧化的铜的物质的量为( )| A. | mol | B. | mol | C. | mol | D. | mol |
分析 铜和稀硝酸发生3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,如是很稀的硝酸,可能发生4Cu+10HNO3(稀)=4Cu(NO3)2 +NH4NO3+5H2O,结合反应的方程式计算该题.
解答 解:铜和稀硝酸发生3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,被还原的硝酸等于生成NO的物质的量,
则3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
3 2
n 1mol
n=mol,
如是很稀的硝酸,可能发生4Cu+10HNO3(稀)=4Cu(NO3)2 +NH4NO3+5H2O,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为0.25mol,
只有D符合,
故选D.
点评 本题考查硝酸的性质,侧重于学生的分析能力和计算能力的考查,为高频考点,注意根据反应的方程式进行判断,难度不大,

练习册系列答案
相关题目
12.下列反应的离子方程式正确的是( )
| A. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-十H2O═2HCO3- | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+═Fe2++H2O |
12.下列含有共价键的离子化合物是( )
| A. | MgCl2 | B. | CO2 | C. | KOH | D. | 金刚石 |
11.下列说法不正确的是( )
| A. | 某微粒空间构型为三角锥形,则该微粒一定是极性分子 | |
| B. | 某微粒空间构型为V形,则中心原子一定有孤电子对 | |
| C. | NH4+中N-H键能、键长和键角均相同 | |
| D. | SiF4和SO的中心原子均为sp3杂化,其立体构型都是正四面体 |
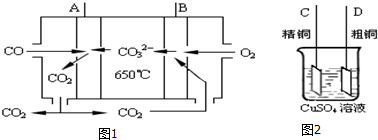
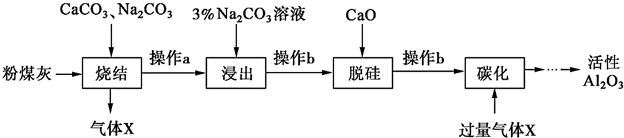
 ;
; ;
; .
.
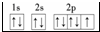 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.