题目内容
9.一氧化碳是一种用途相当广泛的化工基础原料.(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270 kJ•mol-1.
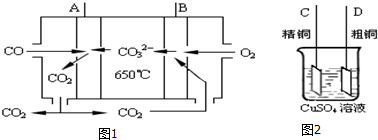
(2)图1是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,图2是粗铜精炼的装置图现用燃料电池为电源进行粗铜的精炼实验
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2.
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与D极 (填:“C”或“D”)相连.
③当消耗1.12L(标况下)CO时,粗铜电极理论上减少铜的质量不超过3.2克.
分析 (1)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(2)根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;根据A为负极,B为正极,
粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及粗铜中除了铜失去电子还有其他金属失去电子.
解答 解:(1)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1
(2)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,
故选:D;
③当消耗1.12L(标况下)CO时,转移0.1mol电子,生成0.05molCu,为0.05mol×64g/mol=3.2g,因粗铜中除了铜失去电子还有其他金属失去电子,根据电子得失守恒可知减少铜的质量小于3.2克,
故答案:3.2.
点评 本题是一道热化学和电化学知识的题目,考查了学生热化学方程式的书写以及电解原理应用的有关知识,综合性强,难度较大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
20.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e-═LiFePO4,负极 Li-e═Li+.下列说法中正确的是( )
| A. | 充电时电池反应为FePO4+Li=LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的正极相连 | |
| C. | 放电时电池内部Li+向负极移动 | |
| D. | 所用的电解质(溶液)为水(溶液) |
4.下列说法错误的是( )
| A. | 氧气和臭氧(O3)是氧元素的同素异形体 | |
| B. | 乙酸和甲酸甲酯是同分异构体 | |
| C. | 12C和13C互为同位素 | |
| D. | 软脂酸(C15H31COOH)和油酸(C17H33COOH)是同系物 |
1.铜跟稀硝酸反应,如果有1mol硝酸被还原了,则被氧化的铜的物质的量为( )
| A. | $\frac{3}{8}$ mol | B. | $\frac{8}{3}$ mol | C. | $\frac{2}{3}$ mol | D. | $\frac{3}{2}$ mol |
18.有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况);E的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:
(1)B在周期表中的位置为第三周期第VA族.
(2)元素A在化合物中一般显负(填正或负)价,但在与F(填元素符号)形成化合物时,所显示的价态正好相反.
(3)比较C、D元素简单离子半径的大小S2->Cl-(填离子符号).
(4)向D与E形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+.
(5)D的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的化学方程式为Mg(OH)2+2HClO4═Mg(ClO4)2+2H2O.
| A | ||
| B | C | D |
(2)元素A在化合物中一般显负(填正或负)价,但在与F(填元素符号)形成化合物时,所显示的价态正好相反.
(3)比较C、D元素简单离子半径的大小S2->Cl-(填离子符号).
(4)向D与E形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+.
(5)D的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的化学方程式为Mg(OH)2+2HClO4═Mg(ClO4)2+2H2O.
19.已知A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1kJ,断开1mol B2中的化学键消耗的能量为Q2kJ,生成1mol AB中的化学键释放的能量为Q3kJ,则下列说法正确的是( )
| A. | 根据能量守恒有Q1+Q2=2Q3 | |
| B. | 该反应中的能量变化为 ︳Q1+Q2-2Q3︳ | |
| C. | 若Q1+Q2>2Q3,则反应为放热反应 | |
| D. | 若1molA2和1molB2的总能量之和小于2molAB的总能量,则反应为放热反应 |


