题目内容
11.下列说法不正确的是( )| A. | 某微粒空间构型为三角锥形,则该微粒一定是极性分子 | |
| B. | 某微粒空间构型为V形,则中心原子一定有孤电子对 | |
| C. | NH4+中N-H键能、键长和键角均相同 | |
| D. | SiF4和SO${\;}_{3}^{2-}$的中心原子均为sp3杂化,其立体构型都是正四面体 |
分析 A.对于ABn型,价层电子对=σ 键电子对+中心原子上的孤电子对,n=4含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子;
B.VSEPR模型为四面体说明该微粒的价层电子对是4,价层电子对=σ 键电子对+中心原子上的孤电子对,空间构型为V形说明该微粒中含有2个孤电子对;
C.NH4+为正四面体结构,4个N-H键相同;
D.根据中心原子的价层电子对数判断.
解答 解:A.微粒中立体构型是三角锥型,说明中心原子A的价电子n=4且含有一个孤电子对,分子结构不对称,为极性分子,如PH3分子中价层电子对数=3+$\frac{1}{2}$×(5-3×1)=4,且含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子,故A正确;
B.对于ABn型,若中心原子A的价电子全部成键,n=2为直线形,n=3为平面三角形,n=4为正四面体;n=4若中心原子A有孤电子对,空间构型为V形,说明该微粒中含有2个孤电子对,如H2O中心原子O原子价层电子对为2+2=4,VSEPR模型为四面体,由于含有2对孤电子对,故为V型,故B正确;
C.NH4+为正四面体结构,离子中N-H键能、键长和键角均相同,故C正确;
D.SiF4中Si原子的价层电子对数为4为sp3杂化,其立体构型是正四面体,SO32-的中心原子的价层电子对数为3+$\frac{1}{2}$×(6+2-3×2)=4为sp3杂化,含有一个孤电子对,其立体构型是三角锥形,故D错误.
故选D.
点评 本题考查了判断分子或离子的空间构型,注意ABn型,若中心原子A的价电子全部成键,n=2为直线形,n=3为平面三角形,n=4为正四面体;若中心原子A有孤电子对,根据中心原子价层电子对判断VSEPR模型,结合孤电子对判断空间构型,题目难度中等,

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案| A. | $\frac{3}{8}$ mol | B. | $\frac{8}{3}$ mol | C. | $\frac{2}{3}$ mol | D. | $\frac{3}{2}$ mol |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 根据能量守恒有Q1+Q2=2Q3 | |
| B. | 该反应中的能量变化为 ︳Q1+Q2-2Q3︳ | |
| C. | 若Q1+Q2>2Q3,则反应为放热反应 | |
| D. | 若1molA2和1molB2的总能量之和小于2molAB的总能量,则反应为放热反应 |
| A. | K+、Cl-、SO${\;}_{4}^{2-}$、Al3+ | B. | Fe2+、NO${\;}_{3}^{-}$、Na+、Cl- | ||
| C. | S2-、Na+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$ | D. | SO${\;}_{3}^{2-}$、K+、NO${\;}_{3}^{-}$、Cl- |
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
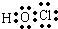
 .
.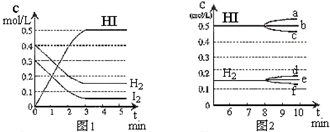 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1: