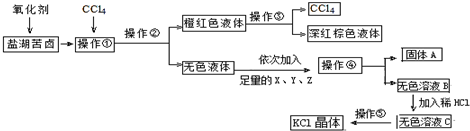
题目内容
12.下列含有共价键的离子化合物是( )| A. | MgCl2 | B. | CO2 | C. | KOH | D. | 金刚石 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,据此分析解答.
解答 解:A.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.二氧化碳分子中C-O原子之间只存在共价键,为共价化合物,故B错误;
C.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物,故C正确;
D.金刚石中C-C原子之间只存在共价键,为单质,故D错误;
故选C.
点评 本题考查化学键、化合物类型判断,侧重考查基本概念,明确物质构成微粒是解本题关键,注意化合物和化学键的关系,题目难度不大.

练习册系列答案
相关题目
3.下列实验现象预测正确的是( )
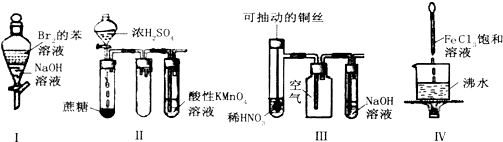

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中无明显现象 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
4.下列离子方程式书写正确的是( )
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| B. | 向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+Cl2+H2O=SO42-+2Cl-+2HSO3- | |
| C. | 电解KBr溶液时阴极的电极反应式为:K++e-=K | |
| D. | 将Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O |
4.下列说法错误的是( )
| A. | 氧气和臭氧(O3)是氧元素的同素异形体 | |
| B. | 乙酸和甲酸甲酯是同分异构体 | |
| C. | 12C和13C互为同位素 | |
| D. | 软脂酸(C15H31COOH)和油酸(C17H33COOH)是同系物 |
1.铜跟稀硝酸反应,如果有1mol硝酸被还原了,则被氧化的铜的物质的量为( )
| A. | $\frac{3}{8}$ mol | B. | $\frac{8}{3}$ mol | C. | $\frac{2}{3}$ mol | D. | $\frac{3}{2}$ mol |