题目内容
20.下列有机物中既能发生消去反应得到烯烃,又能发生催化氧化反应得到醛的是( )| A. | 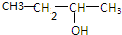 | B. |  | C. | 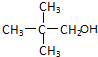 | D. | 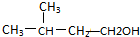 |
分析 根据醇发生消去反应的结构特点是:与羟基所连碳相邻的碳上有氢原子才能发生消去反应,形成不饱和键;醇发生氧化反应的结构特点是:有羟基所连碳上有氢原子的才能发生氧化反应,若生成醛,则羟基所连的C上含有2个H原子.
解答 解:A、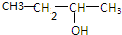 可以发生消去反应生成丁烯,发生氧化反应生成丁酮,故A错误;
可以发生消去反应生成丁烯,发生氧化反应生成丁酮,故A错误;
B、 可以发生消去反应生成戊烯,但由于与羟基所连C上午H原子,故不能发生氧化反应,故B错误;
可以发生消去反应生成戊烯,但由于与羟基所连C上午H原子,故不能发生氧化反应,故B错误;
C、 不能发生消去反应,故C错误;
不能发生消去反应,故C错误;
D、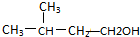 能发生消去反应生成戊烯,能发生氧化反应生成戊醛,故D正确,
能发生消去反应生成戊烯,能发生氧化反应生成戊醛,故D正确,
故选D.
点评 本题考查醇的消去反应、氧化反应,难度不大,注意羟基发生消去反应的结构特点是:与-OH相连碳相邻碳上有氢原子的才能发生消去反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列反应中反应类型不相同的是( )
| A. | 乙烯与水反应生成乙醇,乙炔与氢气反应 | |
| B. | 光照下,丙烷与氯气的反应;丙炔与溴的四氯化碳溶液反应 | |
| C. | 丙烯与酸性高锰酸钾溶液反应;丁烷燃烧 | |
| D. | 乙烯生成聚乙烯,乙炔生成聚乙炔 |
11.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子的电子式是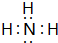 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
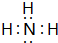 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
8.下列变化中,不需要破坏化学键的是( )
| A. | 干冰气化 | B. | 加热氯化铵 | C. | 食盐熔化 | D. | 氯化氢溶于水 |
5.对于核电荷数为37的元素,下列描述正确的是( )
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
16.在恒温恒容的密闭容器中发生反应:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g).下列说法不正确的是( )
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
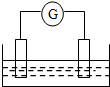 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: