��Ŀ����
15��A��B��C��D��E��F�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӻ���ֻ��һ�����ӣ�BԪ�ص�����������Ӧˮ����������̬�⻯�ﷴӦ����һ����X��D��Aͬ���壬����Fͬ���ڣ�FԪ�ص��������������������������3/4����A��B��D��F������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�������ֻ����D��E��F����Ԫ�ض�Ӧ������������ˮ������������ܷ�Ӧ����ش��������⣺��1��д��A��C��D��EԪ�ص�����A�⡢C����D�ơ�E����FԪ�������ڱ��е�λ�õ������ڵڢ�A�壨���ں��壩��
��2��������֤C��F����Ԫ�طǽ�����ǿ���Ľ����ǣ����ţ��ڢۣ�
�ٱȽ�������Ԫ�س������ʵ��۵� �ڱȽ�������Ԫ�صĵ������������ϵ����׳̶�
�۱Ƚ�������Ԫ�ص��⻯��Ļ�ԭ��
��3��A��C��D��F����Ԫ�ؿ����γ�������ʽ�Σ���������Ԫ����ɣ�����������ʽ�εĻ�ѧʽ
�ֱ�ΪNaHSO4��NaHSO3��
��4��A��B��C����Ԫ�ؼ���γɼס����������ӣ����Ǿ�����10�����ӣ�������ҷ�Ӧ�����ӷ���ʽΪOH-+NH4+=NH3•H2O ��H3O++OH-=2H2O����дһ�����ɣ�
��5������a mol E���Ȼ������Һ�м��뺬b mol D������������Ӧˮ�������Һ������
���������ʵ���������Ϊ���ڣ�������ţ���a mol ��b mol ��b/3mol ��0��
���� A��B��C��D��E��F�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӻ���ֻ��һ�����ӣ���AΪHԪ�أ�BԪ�ص�����������Ӧˮ����������̬�⻯�ﷴӦ����һ����X����BΪNԪ�أ�XΪNH4NO3��FԪ�ص��������������������������$\frac{3}{4}$����ԭ��ֻ����3�����Ӳ㣬����������Ϊ6����FΪSԪ�أ�D��Aͬ���壬����Fͬ���ڣ�����֪DΪNaԪ�أ�D��E��F����Ԫ�ض�Ӧ������������ˮ������������ܷ�Ӧ��Ӧ������������ǿ�ᡢǿ�Ӧ����EΪAl��A��B��D��F������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�������ֻ��������֪CΪOԪ�أ��ݴ˽��
��� �⣺A��B��C��D��E��F�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ�Ӻ���ֻ��һ�����ӣ���AΪHԪ�أ�BԪ�ص�����������Ӧˮ����������̬�⻯�ﷴӦ����һ����X����BΪNԪ�أ�XΪNH4NO3��FԪ�ص��������������������������$\frac{3}{4}$����ԭ��ֻ����3�����Ӳ㣬����������Ϊ6����FΪSԪ�أ�D��Aͬ���壬����Fͬ���ڣ�����֪DΪNaԪ�أ�D��E��F����Ԫ�ض�Ӧ������������ˮ������������ܷ�Ӧ��Ӧ������������ǿ�ᡢǿ�Ӧ����EΪAl��A��B��D��F������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�������ֻ��������֪CΪOԪ�أ�
��1��������������֪��AΪ��Ԫ�ء�CΪ��Ԫ�ء�DΪ��Ԫ�ء�EΪ��Ԫ�أ�FΪ��Ԫ�أ�Ԫ�������ڱ��е�λ��Ϊ���������ڵڢ�A�壬
�ʴ�Ϊ���⣻�����ƣ������������ڵڢ�A�壻
��2���ٵ����۵�Ϊ�������ʣ����ܱȽ�Ԫ�طǼ���ǿ�����ʴ���
�ڵ�������������Խ���ף�˵��Ԫ�صķǽ�����Խǿ������ȷ��
�۷ǽ���Ԫ���⻯�ﻹԭ��Խǿ����Ԫ�صķǽ�����Խ��������ȷ��
��ѡ���ڢۣ�
��3��H��O��Na��S����Ԫ�ؿ����γ�������ʽ�Σ���������Ԫ����ɣ�����������ʽ�εĻ�ѧʽ�ֱ�Ϊ NaHSO4��NaHSO3��
�ʴ�Ϊ��NaHSO4��NaHSO3��
��4��H��N��O����Ԫ�ؼ���γɼס����������ӣ����Ǿ�����10�����ӣ��������ķ�Ӧ����������ΪOH-��NH4+��H3O+��OH-��������ҷ�Ӧ�����ӷ���ʽΪ��OH-+NH4+=NH3•H2O ��H3O++OH-=2H2O��
�ʴ�Ϊ��OH-+NH4+=NH3•H2O ��H3O++OH-=2H2O��
��5������a mol AlCl3����Һ�м��뺬b mol NaOH����Һ��������Ӧ����AlCl3+3NaOH=Al��OH��3��+3NaCl����AlCl3+4NaOH=NaAlO2+3NaCl��
��a��b��1��3ʱ��ֻ������Ӧ�٣�����ǡ�÷�Ӧʱ�õ�����Ϊamol��$\frac{b}{3}$mol���Ȼ�������ʱ���õ�����amol��С��amol������Ϊ$\frac{a}{3}$mol��
��a��b��1��4ʱ��ֻ������Ӧ�ڣ�û�г������ɣ�������Ϊ0��
��1��3��a��b��1��4ʱ��������Ӧ�٢ڣ���
AlCl3+3NaOH=Al��OH��3��+3NaCl
xmol 3xmol xmol��
AlCl3+4NaOH=NaAlO2+3NaCl��
��a-x��mol 4��a-x��mol
��3xmol+4��a-x��mol=b�����x=��4a-b����������Ϊ��4a-b��mol�����ڲ���������ת��Ϊ������������������Ϊ$\frac{a}{3}$mol��
���������غ��֪���������������ʵ��������ܵ���NaOH���ʵ���������������Ϊbmol��
���Ϸ�����֪����������Ϊ��a mol����$\frac{b}{3}$mol����0�������ܢ�b mol��
�ʴ�Ϊ���ڣ�
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��ƶ�Ԫ���ǽ���ؼ���ע�����ճ���10���ӡ�18����������5���м���������ĸ�����ۼ��㣬Ϊ�״��㣬���ؿ���ѧ�����������������Ѷ��еȣ�


��1��ʵ�����¶ȶԷ�Ӧ���ù���������ˮ����ͭ��CuSO4���ĺ�����Ӱ����ͼ��ʾ������������Ӧ���¶ȿ�����600�����ң��¶�������һ���̶Ⱥ�ˮ����ͭ�����½��Ŀ���ԭ����CuSO4�����˷ֽⷴӦ��
��2���±��г�����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0mol•L-1���㣩��ʵ���п�ѡ�õ��Լ�����Ʒ��ϡ���ᡢ3% H2O2��Һ��CuO��������������pH��ֽ��
��ʵ��ʱ����Լ3%��H2O2��Һ100mL����������30%���ܶȽ���Ϊ1g•cm-3����H2O2�����ƣ���������Ʒ���������Ͳ��ȡ10mL30%H2O2��Һ�����ձ��У��ټ���90mL ˮ�����ˮϡ���� 100mL����������ȣ�
�ڲ��������ɷ�Ӧ���ù�������X�Ƶô������������ʵ�鲽�裺
��һ�����������������ϡ���ᣬ���衢��ַ�Ӧ�����ˣ�
| ���� | Cu2+ | Fe2+ | Fe3+ |
| ��ʼ����ʱ��pH | 4.7 | 5.8 | 1.9 |
| ��ȫ����ʱ��pH | 6.7 | 9.0 | 3.2 |
������������Һ�м���CuO���þ���pH��ֽ����pH��3.2��4.7֮�䣬���ˣ�
���IJ�������Ũ������ȴ�ᾧ��
���岽�����ˡ�ϴ�ӣ����¸��
��3�������ԡ����������£�һ�ֽ�Thibacillus ferroxidans��ϸ���ܽ���ͭ��ת���������Σ��ù��̷�Ӧ�����ӷ���ʽΪ4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O��
| A�� | ����Ԫ��ԭ�������ĵ�����ԭ���������������Ǵ�1��8�ظ����� | |
| B�� | Ԫ�ص���������ԭ�������ĵ������������Ա仯 | |
| C�� | ����Ԫ��ԭ�������ĵ�����Ԫ�ص�������۴�+1��+7�����۴�-7��-1�ظ����� | |
| D�� | ����Ԫ��ԭ�ӵ�������ۺ��۵ľ���ֵ֮��һ����8 |
| A�� | ��R��OH��nΪǿ���W��OH��mҲΪǿ�� | |
| B�� | ��HnXOmΪǿ�ᣬ��Y�ǻ��÷ǽ���Ԫ�� | |
| C�� | ��Y����ͻ��ϼ�Ϊ-2����Z����������ϼ�Ϊ+6 | |
| D�� | ��X����������ϼ�Ϊ+5��������Ԫ�ض��Ƿǽ���Ԫ�� |
| A�� | BaCl2 | B�� | H2O | C�� | HCl | D�� | Ba��OH��2 |
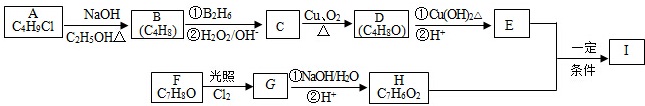
 +2Cl2$\stackrel{����}{��}$
+2Cl2$\stackrel{����}{��}$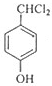 +2HCl���÷�Ӧ����Ϊȡ����Ӧ��
+2HCl���÷�Ӧ����Ϊȡ����Ӧ�� ��
�� ��
��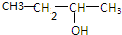

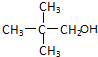
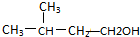

 ��
��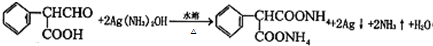 ��
��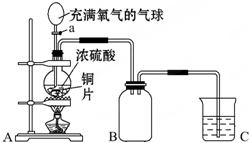 С��ͬѧ�������ͼ��ʾװ����̽��ͭ��Ũ����ķ�Ӧ��
С��ͬѧ�������ͼ��ʾװ����̽��ͭ��Ũ����ķ�Ӧ��