题目内容
16.在恒温恒容的密闭容器中发生反应:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g).下列说法不正确的是( )| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
分析 A.化学平衡常数,是指在一定温度下,可逆反应到达平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不需要写出;
B.随反应进行,用于判断平衡状态的物理量由变化到不再变化,说明到达平衡;
C.等效为增大压强,反应气体气体体积不变,压强不影响平衡移动;
D.根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比等于其化学计量数之比计算v(H2O).
解答 解:A.化学平衡常数,是指在一定温度下,可逆反应到达平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不需要写出,反应Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g)的平衡常数表达式K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$,故A正确;
B.反应前后气体体积不变,所以压强始终不变,压强不变不能说明反应到达平衡,故B错误;
C.改变起始充入H2的浓度,等效为增大压强,反应气体气体体积不变,压强不影响平衡移动,氢气的转化率不变,故C正确;
D.经2min后,H2浓度下降了0.1mol.L-1,则v(H2)=$\frac{0.1mol/L}{2min}$=0.05mol/(L.min),速率之比等于其化学计量数之比,则v(H2O)=v(H2)=0.05mol/(L.min),故D正确,
故选B.
点评 本题考查化学平衡常数、平衡状态判断、化学平衡影响因素、反应速率计算等,C选项中注意利用等效平衡分析,也可以借助平衡常数进行理解,难度中等.

练习册系列答案
相关题目
19.常温常压下,某气态烃和氧气的混合气体20L,完全燃烧后通过浓硫酸后,再恢复到原来条件,气体体积变为原来的一半.设烃完全燃烧无剩余,则该烃可能是( )
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
| A. | 只有①③④ | B. | ⑤⑥⑦⑧ | C. | 只有②⑦ | D. | ①②④⑦ |
1.在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列说法正确的是( )
| A. | 2mol甲醇参加反应,放出的热量为25kJ | |
| B. | 浓硫酸在反应中只作催化剂 | |
| C. | 2υ(CH3OH)=υ(CH3OCH3) | |
| D. | 升高温度或增大压强均可加快反应速率 |
8.利用下列实验装置图可以达到实验目的是( )
| A. | 此装置可以实现Cl2的制取、收集、尾气吸收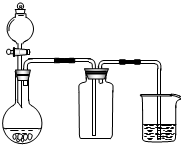 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3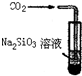 |
6.在下列各溶液中,离子可能大量共存的是( )
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、H+、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
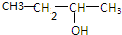

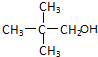
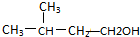
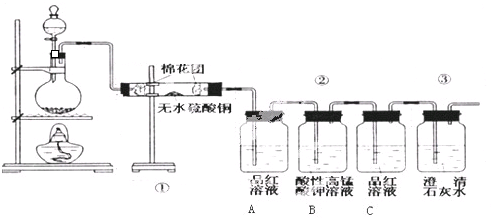
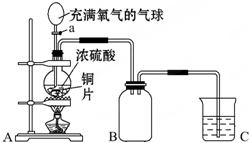 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.