题目内容
17.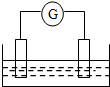 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:(1)若两个电极分别是Zn、Cu,电解质溶液是稀硫酸,正极的电极反应式为2H++2e-=H2↑;如果把电解质溶液换成硫酸铜溶液,则正极的电极反应式为Cu2++2e-=Cu.
(2)若总反应是2FeCl3+Fe=3FeCl2,则可以做负极材料的是Fe,负极上发生的电极反应是Fe-2e-=Fe2+.
(3)若电解质溶液是稀硫酸,Mg、Al两种金属做电极,则Mg电极的电极反应式为Mg-2e-=Mg2+;若电解质溶液换作稀氢氧化钠溶液,Mg、Al两金属做电极,则Mg是正极(填“正极”或“负极”),总反应的离子方程式是2Al+2H2O+2OH-=2AlO2-+3H2↑.
分析 (1)铜锌原电池中,活泼金属作负极,在正极上有气体生成;若电解质为硫酸铜溶液,则在正极上析出铜;
(2)根据反应“2FeCl3+Fe=3FeCl2”可知,反应中铁失电子而被氧化,应为原电池负极,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,依次分析解答;
(3)Mg、Al两种金属做电极,若电解质溶液是稀硫酸,Mg失电子是负极;若电解质溶液换作稀氢氧化钠溶液,Al失电子是负极.
解答 解:(1)将Zn棒和Cu棒用导线连接后,若电解质溶液为稀硫酸,则锌为负极,铜为正极,负极反应为Zn-2e-=Zn2+,正极反应为:2H++2e-=H2↑,在正极上有气体生成;将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则在正极上析出铜,锌为负极,负极反应为Zn-2e-=Zn2+,正极反应为Cu2++2e-=Cu,
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(2)由反应“2FeCl3+Fe=3FeCl2”可知,反应中铁失电子而被氧化,应为原电池负极,负极上铁失电子发生氧化反应,正极上铁离子得电子发生还原反应,其电极反应式为:负极为Cu-2e-=Cu2+,正极为2Fe3++2e-=2Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(3)Mg、Al两种金属做电极,若电解质溶液是稀硫酸,Mg失电子是负极,电极反应式为:Mg-2e-=Mg2+;若电解质溶液换作稀氢氧化钠溶液,Al失电子是负极,Mg为正极,正反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:Mg-2e-=Mg2+;正极;2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评 本题考查原电池的设计及原电池的工作原理、电极反应式书写,题目难度不大,利用基础知识可以解答.

| A. | 此装置可以实现Cl2的制取、收集、尾气吸收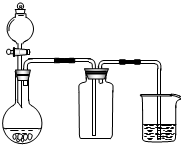 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3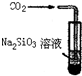 |
| A. | BaCl2 | B. | H2O | C. | HCl | D. | Ba(OH)2 |
| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
| A. | Na,Mg,Al | B. | N,O,F | C. | Li,Na,K | D. | I,Br,Cl |
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、H+、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
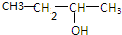

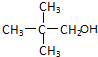
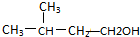
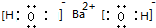 .
.