题目内容
12.CH4,H2,C完全燃烧的化学方程式如下:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.6kJ•mol-1
(1)现完全燃烧等质量的CH4,H2,C,放出热量由少到多的次序为H2>CH4>C;
(2)若完全燃烧等物质的量的CH4,H2,C,放出热量由少到多的次序为CH4>C>H2.
分析 (1)根据热化学方程式的意义计算出1克物质完全燃烧后放出的热量,然后比较大小;
(2)根据热化学方程式的意义得1mol物质完全燃烧后放出的热量,然后比较大小;
解答 解:(1)由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1可知1克CH4完全燃烧后放出的热量为$\frac{890kJ}{16}$=55.625kJ,
由H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1可知1克H2完全燃烧后放出的热量为$\frac{285.8kJ}{2}$=142.9kJ,
由C(s)+O2(g)=CO2(g)△H=-393.6kJ•mol-1可知1克C完全燃烧后放出的热量为=$\frac{393.6kJ}{12}$=32.8kJ,
所以完全燃烧等质量的CH4,H2,C,放出热量由少到多的次序为H2>CH4>C;
故答案为:H2>CH4>C;
(2)由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1可知1molCH4完全燃烧后放出的热量为890kJ;
由H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1可知1molH2完全燃烧后放出的热量为285.8kJ;
由C(s)+O2(g)=CO2(g)△H=-393.6kJ•mol-1可知1molC完全燃烧后放出的热量为393.6kJ;
所以完全燃烧等物质的量的CH4,H2,C,放出热量由少到多的次序为CH4>C>H2;
故答案为:CH4>C>H2;
点评 本题主要考查了反应中热效应的计算,掌握热化学方程式的意义是解题的关键,难度不大.

练习册系列答案
相关题目
2.下列化学式只表示一种纯净物的是( )
| A. | C3H8 | B. | C4H10 | C. | C2H4Br2 | D. | C3H8O |
3.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
8.利用下列实验装置图可以达到实验目的是( )
| A. | 此装置可以实现Cl2的制取、收集、尾气吸收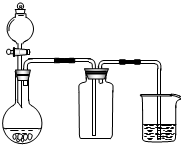 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3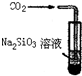 |
9.下列各组元素原子中,金属性依次增强的是( )
| A. | Na,Mg,Al | B. | N,O,F | C. | Li,Na,K | D. | I,Br,Cl |
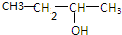

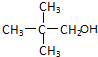
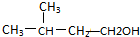

 ;
;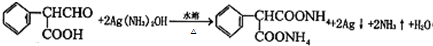 .
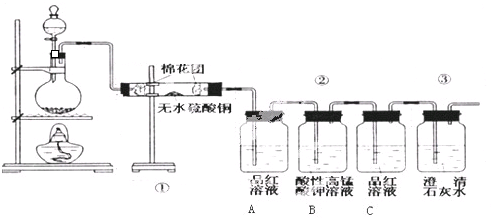
.
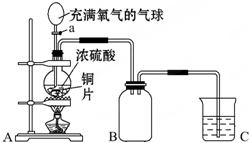 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.