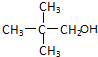
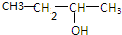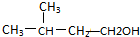题目内容
5.对于核电荷数为37的元素,下列描述正确的是( )| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
分析 依据原子核外电子排布规律可知核电荷数为37的元素核外有4个电子层,各层容纳电子数分别为2、8、8、8、1,为第五周期第ⅠA族元素,依据同主族元素性质的递变规律结合钠、钾的性质解答.
解答 解:依据原子核外电子排布规律可知核电荷数为37的元素核外有4个电子层,各层容纳电子数分别为2、8、18、1,为Rb,为第五周期第ⅠA族元素,
A.Rb排在钠、钾的下面,与钠、钾同主族,金属性强于钠,钾,常温下跟水反应比钠剧烈,故A错误;
B.依据碳酸钠、碳酸钾易溶于水可知碳酸銣易溶于水,故B正确;
C.Rb电子层数多于钾,原子半径大于钾,故C错误;
D.Rb排在钠、钾的下面,金属性强于钠和钾,对应最高价氧化物的水化物碱性强于氢氧化钠和氢氧化钾,能够与氢氧化铝反应生成可溶性偏铝酸銣,故D错误;
故选:B.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
15.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
| A. | H2S+2HNO3=S↓+2NO2↑+2H2O | B. | Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O | ||
| C. | CuO+2HNO3=Cu(NO3)2+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
16.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子分子中 | |
| D. | 含有共价键的化合物都是共价键化合物 |
1.在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列说法正确的是( )
| A. | 2mol甲醇参加反应,放出的热量为25kJ | |
| B. | 浓硫酸在反应中只作催化剂 | |
| C. | 2υ(CH3OH)=υ(CH3OCH3) | |
| D. | 升高温度或增大压强均可加快反应速率 |
2.设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
 O2
O2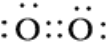 NH4+
NH4+ Na2O2
Na2O2
 CH4:
CH4: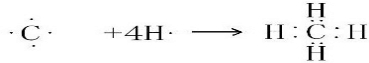 .
.