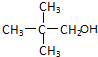
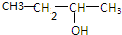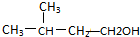题目内容
11.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
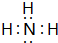 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
分析 A、B、C、D、E是中学化学中五种常见元素,A元素高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C单质须保存在煤油中,则C为Na;D单质与NaOH溶液反应可用于生产漂白液,则D为Cl;E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe,据此解答.
解答 解:A、B、C、D、E是中学化学中五种常见元素,A元素高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C单质须保存在煤油中,则C为Na;D单质与NaOH溶液反应可用于生产漂白液,则D为Cl;E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe,
(1)A的氢化物为NH3,电子式是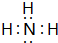 ,硝酸与氨气反应的离子方程式:NH3+H+=NH4+,故答案为:
,硝酸与氨气反应的离子方程式:NH3+H+=NH4+,故答案为: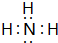 ;NH3+H+=NH4+;
;NH3+H+=NH4+;
(2)O、Na组成的某种化合物和氧元素的某种氢化物反应可生成氧气,应是过氧化钠与水反应生成氢氧化钠与氧气,则B、C组成的该化合物Na2O2,含有离子键、共价键,故答案为:离子键、共价键;
(3)A、D的氢化物分别为NH3、HCl,相互反应产生白色固体为NH4Cl,该固体中阳离子为NH4+,检验铵根离子方法为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明含有NH4+,
故答案为:NH4Cl;取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
点评 本题考查结构性质位置关系应用,题目难度不大,根据物质的性质推断元素的种类是解题关键,注意掌握铵根离子的检验方法.

 名校课堂系列答案
名校课堂系列答案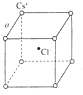 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}{a}^{3}}$g•cm-3 | B. | $\frac{M{a}^{3}}{{8N}_{A}}$g•cm-3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g•cm-3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g•cm-3 |
| A. | C3H8 | B. | C4H10 | C. | C2H4Br2 | D. | C3H8O |
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
| A. | 只有①③④ | B. | ⑤⑥⑦⑧ | C. | 只有②⑦ | D. | ①②④⑦ |
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子分子中 | |
| D. | 含有共价键的化合物都是共价键化合物 |
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
| A. | 此装置可以实现Cl2的制取、收集、尾气吸收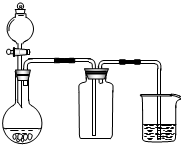 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3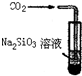 |
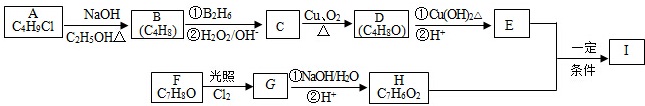
 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$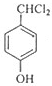 +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.