题目内容
11.W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W的阳离子能抑制水的电离,X、Z同主族,元素原子最外层电子数Z是Y的2倍,四种元素原子最外层电子数之和为16.下列说法正确的是( )| A. | Y的最高价氧化物的水化物具有弱酸性 | |
| B. | 阳离子的氧化性:Y>W | |
| C. | 原子半径:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、4、4 |
分析 W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W的阳离子能抑制水的电离,H+或OH-抑制水电离,则W为H元素;X、Z同主族,则X、Z最外层电子数相同;
元素原子最外层电子数Z是Y的2倍,四种元素原子最外层电子数之和为16,设Y最外层电子数是a,则四种元素最外层电子数=1+2a+a+2a=16,a=3,所以X、Y、Z最外层电子数分别是6、3、6,则X、Y、Z分别是O、Al、S元素,
A.Y是Al元素,Y的最高价氧化物的水化物是氢氧化铝,具有两性;
B.原子越容易失电子,则其简单阳离子较难得电子,阳离子的氧化性减弱;
C.同一周期元素,原子半径随着原子序数增大而减小;
D.元素W、X、Z各自最高和最低化合价的代数和分别为0、-2、4.
解答 解:W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W的阳离子能抑制水的电离,H+或OH-抑制水电离,则W为H元素;X、Z同主族,则X、Z最外层电子数相同;
元素原子最外层电子数Z是Y的2倍,四种元素原子最外层电子数之和为16,设Y最外层电子数是a,则四种元素最外层电子数=1+2a+a+2a=16,a=3,所以X、Y、Z最外层电子数分别是6、3、6,则X、Y、Z分别是O、Al、S元素,
A.Y是Al元素,Y的最高价氧化物的水化物是氢氧化铝,氢氧化铝能溶于强酸和强碱,所以氢氧化铝具有弱碱性和弱酸性,即具有两性,故A正确;
B.原子越容易失电子,则其简单阳离子较难得电子,阳离子的氧化性减弱,失电子能力Al>H(Y>W),则阳离子的氧化性:W>Y,故B错误;
C.同一周期元素,原子半径随着原子序数增大而减小,Y、Z同一周期,且原子序数Z>Y,所以原子半径Y>Z,故C错误;
D.元素W、X、Z各自最高和最低化合价的代数和分别为0、-2、4,故D错误;
故选A.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查元素化合物知识及原子结构,正确判断元素是解本题关键,注意O元素没有正化合价,注意氢氧化铝的两性,为易错点.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 常温常压下22.4LCO2分子数少于NA | B. | 1molNaHCO3固体中含有NA个CO32- | ||
| C. | NA个NO与NA个O2混合分子数为2NA | D. | 1molCu反应转移电子数一定是2NA |
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量CO2通入NaOH溶液中,:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和KHSO4溶液反应:OH-+H+═H2O | |
| D. | Na2O溶于稀盐酸:O2-+2H+═H2O |
| A. | NO | B. | N2 | C. | NO2 | D. | NH3 |

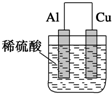

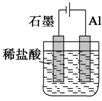
 某种物质的结构如图所示,它是某种烃的衍生物的3个分子间相互加成生成的,这种烃的衍生物是甲醛.
某种物质的结构如图所示,它是某种烃的衍生物的3个分子间相互加成生成的,这种烃的衍生物是甲醛.