题目内容
2.为将反应2Al+6H+═2Al3++3H2↑的化学能转化为电能,下列装置能达到目的是(铝条均已除去了氧化膜)( )| A. |  | B. | 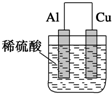 | C. |  | D. | 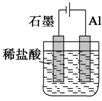 |
分析 将反应2Al+6H+═2Al3++3H2↑的化学能转化为电能,即形成原电池,并且铝为负极,电解质溶液为非氧化性稀酸,据此分析.
解答 解:A.为原电池,总反应为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故A不选;
B.为原电池,总反应为2Al+6H+═2Al3++3H2↑,故B选;
C.为原电池,总反应为Al+4H++NO3-═Al3++NO↑+2H2O,故C不选;
D.为电解池,故D不选;
故选B.
点评 本题考查原电池的总反应,注意判断装置及工作原理为解答的关键,明确正负极及电池总反应即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
12.沼气是一种能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )
| A. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-890 kJ•mol-1 | |
| D. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H═-890 kJ•mol-1 |
13.将30mL5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
| A. | 0.3 mol/L | B. | 3 mol/L | C. | 0.15 mol/L | D. | 1.5 mol/L |
7.有关金属腐蚀的论述,正确的是( )
| A. | 金属的腐蚀一定伴有电流产生 | |
| B. | Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀 | |
| C. | 发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀 | |
| D. | 发生电化学腐蚀时都有能量的转变,且被腐蚀的金属总是失电子 |
14.碘元素有“智力元素”之称.研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量.
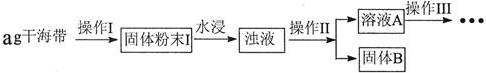
(1)操作Ⅰ为灼烧,则灼烧时用坩埚 盛装海带,操作Ⅱ为过滤
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2S2O32-═2I-+S4O62-
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCL2溶液、稀硫酸
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4
溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B
②在溶液B加入两滴淀粉溶液,用0.01mol/LNaS2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量$\frac{1.27V}{a}$×100%.
(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)

(1)操作Ⅰ为灼烧,则灼烧时用坩埚 盛装海带,操作Ⅱ为过滤
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2S2O32-═2I-+S4O62-
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCL2溶液、稀硫酸
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 |  |
| ② | 往试管Ⅰ中加入FeCl2溶液后,加入2滴KSCN溶液并振荡 | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4
溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B
②在溶液B加入两滴淀粉溶液,用0.01mol/LNaS2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量$\frac{1.27V}{a}$×100%.
(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)
11.W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W的阳离子能抑制水的电离,X、Z同主族,元素原子最外层电子数Z是Y的2倍,四种元素原子最外层电子数之和为16.下列说法正确的是( )
| A. | Y的最高价氧化物的水化物具有弱酸性 | |
| B. | 阳离子的氧化性:Y>W | |
| C. | 原子半径:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、4、4 |
12.某溶液经经测定pH=1,溶液中还存在Ba2+、Fe2+,此溶液中还可能大量存在的离子是( )
| A. | SO42- | B. | CO32- | C. | NO3- | D. | Br- |