题目内容
3.在13g锌粉中加入过量的20%的硫酸铜溶液,充分反应后过滤,得到242.2g溶液,则反应后溶液中剩余的硫酸铜的质量是多少?分析 根据锌的质量可求参加反应的硫酸铜的质量和生成的铜的质量;根据“反应后所得溶液的质量=锌粉的质量+原硫酸铜溶液的质量-生成铜的质量”,得出原硫酸铜溶液的质量;反应后溶液中剩余的硫酸铜的质量=原硫酸铜的质量-参加反应的硫酸铜的质量,据此分析.
解答 解:设参加反应的硫酸铜的质量为x,生成的铜的质量为y
Zn+CuSO4=Cu+ZnSO4
65 160 64
13g x y
$\frac{65}{13g}=\frac{160}{x}=\frac{64}{y}$,解之得x=32g,y=12.8g
反应后所得溶液的质量=锌粉的质量+原硫酸铜溶液的质量-生成铜的质量,即:
242.2g=13g+原硫酸铜溶液的质量-12.8g,得:
原硫酸铜溶液的质量=242.2g-13g+12.8g=242g;
剩余的硫酸铜的质量=原硫酸铜的质量-参加反应的硫酸铜的质量=242g×20%-32g=16.4g
答:则反应后溶液中剩余的硫酸铜的质量是16.4g.
点评 根据“反应后所得溶液的质量=锌粉的质量+原硫酸铜溶液的质量-生成铜的质量”,求出原硫酸铜溶液的质量是关键.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
13.下列分子构型呈正四面体结构的是( )
①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
14.某有机物的结构简式为CH2=CH-CH-CHO,下列对其化学性质的判断中,不正确的是( )
| A. | 能被银氨溶液氧化 | |
| B. | 能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol该有机物只能与1molBr2发生加成反应 | |
| D. | 1mol该有机物只能与1molH2发生加成反应 |
8.下列化学用语表达正确的是( )
| A. | 环已烷的结构简式  | B. | C2H4的球棍模型 | ||
| C. | 四氯化碳的电子式 | D. | 苯的分子式 |
12.乙酸和乙烯的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{1}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$ (1-a) | D. | $\frac{12}{13}$ (1-a) |
 ;
;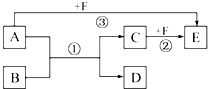 已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:
已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题: