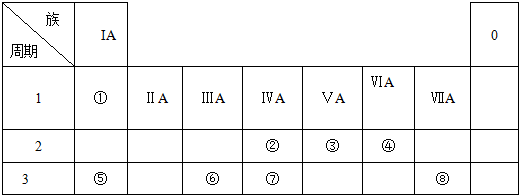
题目内容
18.前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.(1)D在周期表中的位置第四周期第ⅠA族;
(2)B 元素的原子结构示意图

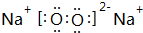
(3)化合物D2C的电子式
 ;
;(4)B的氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):NH3>CH4;
(5)C、D离子的半径大小关系为C>D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的化学键有B(填选项).
A、只含离子键 B、既有离子键又有极性共价键
C、只含有共价键 D、既有极性共价键又有非极性共价键.
分析 前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,处于ⅤA族,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,则C为S元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,D在第四周期第ⅠA族,则D为K,据此进行解答.
解答 解:A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,处于ⅤA族,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,则C为S元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,D在第四周期第ⅠA族,则D为K,
(1)由以上分析,B为K元素,位于元素周期表中第四周期第ⅠA族,
故答案为:第四周期第ⅠA族;
(2)B为N元素,其原子序数为7,氮原子的原子结构示意图为: ,
,
故答案为: ;
;
(3)D2C为K2S,属于离子化合物,含有离子键,其电子式为: ,
,
故答案为: ;
;
(4)B的氢化物为氨气,最简单的有机物为甲烷,非金属性N>C,则二者的稳定性:NH3>CH4,
故答案为:NH3;CH4;
(5)C为S、D为K,离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,硫离子比钾离子的电子层相同,钾离子的核电荷数大于硫离子,则硫离子半径大于钾离子,即:C>D,
故答案为:>;
(6)B的氢化物为氨气,B的最高价氧化物对应水化物为硝酸,二者反应的生成物为硝酸铵,硝酸铵为离子化合物,其化学式中既含有离子键,也含有共价键,故B正确,
故答案为:B.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,明确比较粒子比较大小的方法.

| A. | 向100 mL 0.1 mol/L的FeSO4溶液中,加入0.01 mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | 向 FeBr2溶液中通入足量Cl2:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
| A. | 原子序数为24 | |
| B. | 最高价氧化物为SeO3,为酸性氧化物 | |
| C. | 原子半径比钙大 | |
| D. | 气态氢化物比H2S稳定 |
| A. | N2的化学性质比O2稳定 | B. | HNO3易挥发,H2SO4难挥发 | ||
| C. | 常温、常压下,溴呈液态,碘呈固态 | D. | 稀有气体很难发生化学反应 |
 .
.
 .
. .
. .
. .
.