题目内容
13.下列分子构型呈正四面体结构的是( )①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
分析 分子构型呈正四面体结构,说明该物质是分子晶体,分子中中心原子价层电子对个数是4且不含孤电子对,据此分析解答.
解答 解:①P4是分子晶体,为正四面体结构,四个P原子分别位于正四面体四个顶点上,故正确;
②NH3为分子晶体,N原子价层电子对是4且含有一个孤电子对,所以为三角锥形结构,故错误;
③CCl4为分子晶体,C原子价层电子对个数是4且不含孤电子对,所以为正四面体结构,故正确;
④金刚石为原子晶体,没有分子,故错误;
⑤CH4为分子晶体,C原子价层电子对个数是4且不含孤电子对,所以为正四面体结构,故正确;
⑥SiO2为原子晶体,没有分子,故错误;
⑦H2O为分子晶体,O原子价层电子对个数是4且含有两个孤电子对,所以为V形结构,故错误;
⑧CO2为分子晶体,C原子价层电子对个数是2且不含孤电子对,为直线形结构,故错误;
故选C.
点评 本题考查分子空间构型及晶体类型判断,为高频考点,明确价层电子对互斥理论及其适用范围即可解答,易错选项是④,金刚石中每个C原子和四个C原子形成正四面体结构,但金刚石是原子晶体,题目难度不大.

练习册系列答案
相关题目
13.达到化学平衡的条件是( )
| A. | 逆反应停止 | B. | 正逆反应速率相等 | ||
| C. | 反应停止产生热 | D. | 反应物与产物浓度相等 |
18.化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是( )
| A. | 向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点 |
5.下列各种醇中能够发生消去反应生成具有相同碳原子数的烯的是( )
| A. | CH3OH | B. | 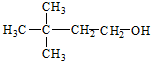 | ||
| C. | 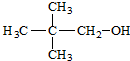 | D. | 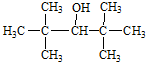 |
2.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的元素名称是碳,元素Z的离子结构示意图为
(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |

(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
 数目增多 ④c(OH-)增大 ⑤导电性增强
数目增多 ④c(OH-)增大 ⑤导电性增强
 .
.