题目内容
14.某有机物的结构简式为CH2=CH-CH-CHO,下列对其化学性质的判断中,不正确的是( )| A. | 能被银氨溶液氧化 | |
| B. | 能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol该有机物只能与1molBr2发生加成反应 | |
| D. | 1mol该有机物只能与1molH2发生加成反应 |
分析 该分子中含有碳碳双键和醛基,具有烯烃和醛的性质,能发生氧化反应、加成反应、加聚反应等,据此分析解答.
解答 解:A.该物质中含有醛基,能被银氨溶液氧化,故A正确;
B.该分子中含有醛基和碳碳双键,所以能被酸性高锰酸钾溶液氧化,而使酸性高锰酸钾溶液褪色,故B正确;
C.该分子中含有碳碳双键能和溴发生加成反应,所以1mol该有机物只能与1mol Br2发生加成反应,故C正确;
D.碳碳双键和醛基都能和氢气发生加成反应,1mol该有机物只能与2mol H2发生加成反应,故D错误;
故选D.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查烯烃和醛的性质,注意醛基能被溴氧化,但不能和溴发生加成反应,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列各种醇中能够发生消去反应生成具有相同碳原子数的烯的是( )
| A. | CH3OH | B. | 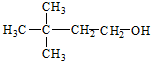 | ||
| C. | 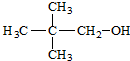 | D. | 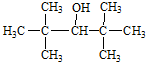 |
2.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的元素名称是碳,元素Z的离子结构示意图为
(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |

(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
9.下列离子方程式正确的是( )
| A. | 向100 mL 0.1 mol/L的FeSO4溶液中,加入0.01 mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | 向 FeBr2溶液中通入足量Cl2:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
19.短周期的同族元素,A和B,B的原子序数比A大,若A的原子序数为m,B的原子序数为n,则n可以是( )
①m+2 ②m+8 ③m+10 ④m+16.
①m+2 ②m+8 ③m+10 ④m+16.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
4.把①蔗糖,②淀粉,③纤维素,④乙酸乙酯在稀硫酸存在下分别进行水解,最终产物只有1种的是( )
| A. | ①和② | B. | 只有③ | C. | 只有④ | D. | 只有②和③ |
 数目增多 ④c(OH-)增大 ⑤导电性增强
数目增多 ④c(OH-)增大 ⑤导电性增强