题目内容
1.下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
(2)氧的原子结构示意图是
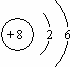 ;
;(3)形成化合物种类最多的元素是C;
(4)HF和H2O中,热稳定性较强的是HF;
(5)N和P中,原子半径较小的是N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2.
分析 (1)稀有气体原子最外层为稳定结构,化学性质最稳定;
(2)O原子质子数为8,原子核外有2个电子层,各层电子数为2、6;
(3)碳元素组成有机物,形成的物质种类最多;
(4)非金属性越强,氢化物越稳定;
(5)同主族自上而下原子半径增大;
(6)常温下,Al在浓硫酸中发生钝化现象;
(7)上述元素中Na的金属性最强,故氢氧化钠碱性最强,F元素没有最高价含氧酸,高氯酸是最强的含氧酸;
(8)硫的一种氧化物可使品红溶液褪色,该氧化物为二氧化硫.
解答 解:(1)稀有气体Ne原子最外层为稳定结构,化学性质最稳定,故答案为:Ne;
(2)O原子质子数为8,原子核外有2个电子层,各层电子数为2、6,原子结构示意图为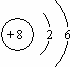 ,故答案为:
,故答案为: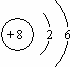 ;
;
(3)碳元素组成有机物,形成的物质种类最多,故答案为:C;
(4)非金属性F>O,非金属性越强,氢化物越稳定,故氢化物稳定性HF>H2O,故答案为:HF;
(5)同主族自上而下原子半径增大,故原子半径N<P,故答案为:N;
(6)常温下,Al在浓硫酸中发生钝化现象,故答案为:Al;
(7)上述元素中Na的金属性最强,故NaOH碱性最强,F元素没有最高价含氧酸,HClO4是最强的含氧酸,酸性比硫酸羟,故答案为:NaOH;HClO4;
(8)硫的一种氧化物可使品红溶液褪色,该氧化物为SO2,故答案为:SO2.
点评 本题考查元素周期表与元素周期律的综合应用,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
11.下列分子中所有碳原子肯定在同一平面上的是( )
| A. | 丙烷 | B. | 异丁烷 | C. | 2-丁烯 | D. | 1-丁烯 |
12.可以把5种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液区分的试剂是( )
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
9.下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 原子晶体中的相邻原子间只存在非极性共价键 |
6.酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+.下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物.
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物.
| A. | ②④ | B. | ②③ | C. | ①③ | D. | ①④ |
10.将下列液体分别与溴水充分混合并振荡,静置后上层液体呈现橙色,下层液体是无色的是( )
| A. | CCl4 | B. | 苯 | C. | 戊烯 | D. | 乙醇 |
 .
.
 .
.