题目内容
11.下列分子中所有碳原子肯定在同一平面上的是( )| A. | 丙烷 | B. | 异丁烷 | C. | 2-丁烯 | D. | 1-丁烯 |
分析 常见具有平面形结构的有机物有苯、乙烯、甲醛,可在此基础上结合甲烷的正四面体结构特征判断有机物的结构,以此解答该题.
解答 解:A.丙烷含有3个C原子,可形成平面形结构,故A正确;
B.异丁烷中2号碳与其余三个碳处于四面体位置,故四个碳原子不可能共平面,故B错误;
C.CH3CH=CHCH3相当于乙烯中的2个H分别被甲基取代生成的,即甲基取代H原子的位置,乙烯中六个原子共平面,故此有机物中四个碳原子可以共平面,故C正确;
D.CH2=CHCH2CH3相当于乙烯中的1个H被乙基取代生成的,即乙基取代H原子的位置,乙烯中六个原子共平面,故此有机物中三个碳原子可以共平面,最后一个甲基与前面的碳形成四面体结构,故四个碳不共平面,故D错误,
故选AC.
点评 本题主要考查有机化合物的结构特点,为高频考点,侧重于学生的分析能力的考查,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
相关题目
1.下列关于甲烷的说法不正确的是( )
| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
2.关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
19.某有机物完全燃烧时只生成水和二氧化碳,且两者的物质的量之比为3:2,则( )
| A. | 该有机物含碳.氢.氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳.氢原子个数之比是2:3 | |
| D. | 该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
20.如图是氢氧燃料电池构造示意图.关于该电池说法正确的是( )
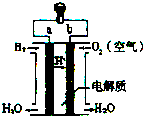

| A. | b是负极 | |
| B. | 需要点燃该电池才能开始工作 | |
| C. | 工作时能观察到淡蓝色火焰 | |
| D. | 氢氧燃料电池是一种高效环境友好的发电装置 |
1.下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
(1)单质的化学性质最不活沷的元素是Ne;
(2)氧的原子结构示意图是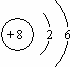 ;
;
(3)形成化合物种类最多的元素是C;
(4)HF和H2O中,热稳定性较强的是HF;
(5)N和P中,原子半径较小的是N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
(2)氧的原子结构示意图是
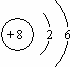 ;
;(3)形成化合物种类最多的元素是C;
(4)HF和H2O中,热稳定性较强的是HF;
(5)N和P中,原子半径较小的是N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2.
 现有丙炔和氢气的混合气体5L,其中氢气在混合气体中的体积分数为x,在催化剂作用下,经充分反应后得到的气体的体积为V L(所有体积均在同温同压下测定).
现有丙炔和氢气的混合气体5L,其中氢气在混合气体中的体积分数为x,在催化剂作用下,经充分反应后得到的气体的体积为V L(所有体积均在同温同压下测定).
 .
. .
.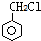 的属于芳香族化合物的同分异构体有3种.
的属于芳香族化合物的同分异构体有3种.