题目内容
9. 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:(1)写出A、B、C、D各电极上的电极方程式:
ACu2++2e-═CuB2Cl--2e-=Cl2↑CAg++e-═AgD4OH--4e-═2H2O+O2↑
(2)若电解后A电极的质量增重6.4g,则D电极产生气体1.12L(标准状况)
(3)若把图左烧杯变为是精炼铜的装置,则A为精铜,B为粗铜;若把图右烧杯变为是铁上镀铜的装置,则C为铁片,D为铜片(A、B、C、D都填电极材料),电解质溶液为硫酸铜溶液.
分析 (1)左、右两个装置都是电解池,左侧装置,A连接电源的负极,为阴极,发生还原反应,Cu2+放电生成Cu,B连接电源的正极,为阳极,发生氧化反应,Cl-放电生成Cl2,阴、阳电极反应式之和为总反应式;右侧装置,C连接电源的负极,为阴极,发生还原反应,Ag+放电生成Ag,D连接电源的正极,为阳极,发生氧化反应,水放电生成O2与H+,阴、阳电极反应式之和为总反应式;
(2)根据A、D的电极反应式结合得失电子守恒进行计算;
(3)精炼铜时用精铜为阴极,粗铜为阳极;铁上镀铜,用铜作阳极,铁作阴极,含铜离子的溶液为电解质溶液,据此分析解答.
解答 解:(1)左、右两个装置都是电解池,左侧装置,A连接电源的负极,为阴极,发生还原反应,Cu2+放电生成Cu,阴极电极反应式为Cu2++2e-═Cu,B连接电源的正极,为阳极,发生氧化反应,Cl-放电生成Cl2,阳极电极反应式为2Cl--2e-=Cl2↑,右侧装置,C连接电源的负极,为阴极,发生还原反应,Ag+放电生成Ag,阴极电极反应式为4Ag++4e-═4Ag,D连接电源的正极,为阳极,发生氧化反应,水放电生成O2与H+,阳极电极反应式为4OH--4e-═2H2O+O2↑,
故答案为:Cu2++2e-═Cu;2Cl--2e-=Cl2↑;Ag++e-═Ag;4OH--4e-═2H2O+O2↑.
(2)A的反应式为Cu2++2e-═Cu,则A电极的质量增重6.4g即转移电子数为$\frac{6.4g}{64g/mol}$×2=0.2mol,又D的电极反应式为4OH--4e-═2H2O+O2↑,所以D电极产生气体为$\frac{0.2mol}{4}$×22.4L/mol=1.12L;故答案为:1.12;
(3)因为精炼铜时用精铜为阴极,粗铜为阳极,所以左烧杯A为阴极为精铜,B为阳极为粗铜;铁上镀铜,用铜作阳极,铁作阴极,含铜离子的溶液为电解质溶液,所以右烧杯变为是铁上镀铜,C为阴极为铁片,D为阳极为铜片,硫酸铜溶液作电解质,故答案为:精铜,粗铜,铁片,铜片,硫酸铜溶液.
点评 本题考查电解原理及其精炼铜、电镀的具体应用,难度不大,掌握离子放电顺序是关键,根据电子转移守恒计算电极产物的物质的量.

 高中必刷题系列答案
高中必刷题系列答案| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 苯酚有毒,但可用于杀菌消毒 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 食醋的主要成分是醋酸,它是一种弱酸 |
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
HgCl2+CH4$\stackrel{微生物}{→}$CH3HgCl+HCl ①水中的NH3在微生物作用下发生如下变化:2NH3+3O2$\stackrel{微生物}{→}$2HNO2+2H2O ②2HNO2+O2$\stackrel{微生物}{→}$2HNO3 ③
下列说法不正确的是 ( )
| A. | 反应①是取代反应,反应②③是氧化还原反应 | |
| B. | 水中溶解的NH3会导致水生动物死亡 | |
| C. | 向氨超标的河水中加稀硫酸是一种行之有效的处理方法 | |
| D. | 自来水中的HgCl2可加入Na2S处理 |
| A. | 镁单质能和冷水发生剧烈的反应 | B. | 碱性Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性SiH4<HCl | D. | 金属性Na<Mg |
(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)
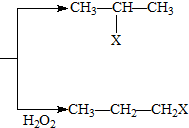 (X为卤素原子)
(X为卤素原子)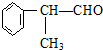 的物质,该物质是一种香料.
的物质,该物质是一种香料.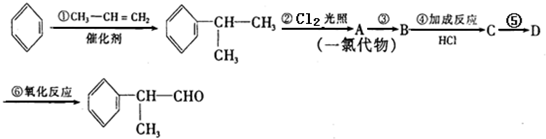
 .
.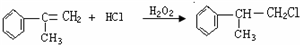 .
.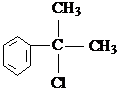 的水解产物
的水解产物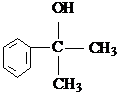 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.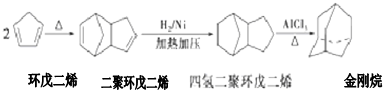
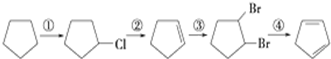
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.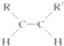 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: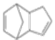 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$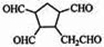 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):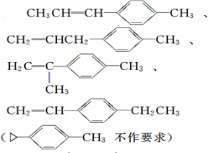 .
.