题目内容
8.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题:(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在25.00mL的酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取20.00mL待测液.该项实验操作使用的主要仪器有碱式滴定管和锥形瓶,用酚酞作指示剂时,滴定到溶液颜色由红色变成无色,且30s不再改变;
(4)滴定达终点后,记下盐酸用去20.00mL,计算氢氧化钠的质量分数为80%;
(5)若所测纯度偏低,可能由下列哪些实验操作引起CE(填序号).
A.取待测液时,锥形瓶未干燥
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时反应器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.滴定开始时读数仰视,终点时读数俯视.
分析 (2)盐酸应用酸式滴定管量取;
(3)待测液为NaOH,选择碱式滴定管或移液管;用酚酞作指示剂时,滴定前,酚酞遇碱变红,滴定后若变无色,停止滴定;
(4)c(HCl)=0.2mol/L,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)计算c(NaOH),进一步计算500mL溶液中NaOH的物质的量,利用样品的质量5.0g计算质量分数;
(5)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
解答 解:(2)盐酸应用酸式滴定管量取,故答案为:酸式;
(3)待测液为NaOH,选择碱式滴定管,放在锥形瓶中;用酚酞作指示剂时,滴定前,酚酞遇碱变红,到达滴定终点时观察到溶液颜色由红色变为无色,
故答案为:碱式滴定管;锥形瓶;红;无;
(4)c(HCl)=0.2mol•L-1,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)可知c(NaOH)=0.2mol/L,
则500mL溶液中NaOH的物质的量为0.5L×0.2mol/L=0.1mol,则NaOH的质量为0.1mol×40g/mol=4.0g,所以5.0g样品中NaOH的质量分数为$\frac{4.0g}{5.0g}$×100%=80%;
故答案为:80%;
(5)A.取待测液时,锥形瓶未干燥,对实验无响应,则测定结果不变,故A错误;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,导致V(酸)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏大,则氢氧化钠的质量分数偏高,故B错误;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少,导致V(酸)减少,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏低,则氢氧化钠的质量分数偏低,故C正确;
D.滴定到终点时,滴定管尖嘴悬有液滴,导致V(酸)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏大,则氢氧化钠的质量分数偏高,故D错误;
E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小,导致V(酸)减少,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏低,则氢氧化钠的质量分数偏低,故E正确;
故答案为:CE.
点评 本题考查中和滴定,把握滴定原理、实验仪器及误差分析为解答的关键,注意误差分析利用计算公式及酸、碱的体积,题目难度不大.

| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物中存在的化学键:离子键和非极性共价键.
(2)写出由2个⑦的原子和4个③的原子构成的物质的电子式:

(3)写出④的最高价氧化物对应水化物与①的最高价氧化物对应水化物的水溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)下列叙述正确的是ABCD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑧在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
(5)①、⑥、⑧可以形成多种盐,其中一种盐中①、⑥、⑧三种元素的原子个数比为1:1:1,该盐的名称为次氯酸钠.它的水溶液与⑥的氢化物的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O.
| A. | 氢化物不稳定 | |
| B. | 最高价氧化物对应的水化物是一种强酸 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 是植物生长所需要的一种营养元素 |
| A. | 12 | B. | 32 | C. | 60 | D. | 80 |
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:

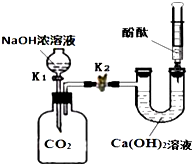 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.