题目内容
19.某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
根据以上信息,下列观点正确的是( )
| A. | 沉淀G的化学式为Fe(OH)2 | |
| B. | 生成气体A的离子方程式为2Fe2++NO3-+4H+=2Fe3++NO↑+2H2O | |
| C. | 反应②中的离子方程式有AlO2-+CO2+2H2O=Al(OH)3+HCO3- | |
| D. | 溶液X中,除H+ 外还肯定含有的离子是NH4+、Fe2+、SO42-. |
分析 在强酸性溶液中一定不会存在CO32-和SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子;由于溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子则一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答.
解答 解:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
A.由于加入了足量的硝酸钡溶液,则亚铁离子完全被氧化成铁离子,则沉淀G为Fe(OH)3,故A错误;
B.A为NO,正确的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故B错误;
C.溶液H中含有偏铝酸根离子,通入过量二氧化碳后生成氢氧化铝沉淀和碳酸氢钠,所以反应②中的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3+HCO3-,故C正确;
D.根据分析可知,一定含有的离子为:Al3+、NH4+、Fe2+、SO42-,故D错误;
故选C.
点评 本题考查了常见离子的检验,题目难度中等,根据题中信息正确推断各离子为解答关键,注意掌握常见离子的性质及检验方法,B注意离子方程式酸性错误,为易错点.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | Mg2+的电子式:Mg2+ | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 丙烷的分子式:CH3CH2CH3 | D. | CH4的立体结构式: |
①CH3(CH2)2CH3;
②CH3(CH2)3CH3;
③(CH3)3CH;
④CH3CH2CH3;
⑤CH3(CH2)4CH3.
| A. | ⑤③①②④ | B. | ⑤②①③④ | C. | ⑤①③②④ | D. | ②⑤③①④ |
| A. | 0.44 s | B. | 2 s | C. | 0.33 s | D. | 1 s |
| A. | B的最简气态氢化物的热稳定性比A的强是因为其最简气态氢化物分子间存在氢键 | |
| B. | 由A元素构成的单质均具有熔点高、硬度大的特性 | |
| C. | 常温下E与D元素形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由A、B、C、D四种元素形成的化合物一定既有离子键,又有共价键 |
| A. | 该晶体中一定含有SCN- | |
| B. | Fe3+的氧化性比Br2的氧化性强 | |
| C. | Fe2+被Br2氧化为Fe3+ | |
| D. | Fe2+ 与SCN-不能形成血红色的化合物 |
| A. | 加热金属铝使之融化 | B. | 液氨受热蒸发 | ||
| C. | 加热碘化氢气体使之分解 | D. | 加热硅晶体使之融化 |
| A. | H2O | B. | KOH | C. | NaCl | D. | NH4Cl |
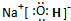 .
.