题目内容
14.A、B、C、D、E为五种短周期元素.A、B、C是原子序数依次递增的同周期元素,且最外层电子数之和为15,A与C可形成AC2分子;B与D形成的气态化合物在标况下的密度为0.76g/L;E的质子数是A、B、C、D四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )| A. | B的最简气态氢化物的热稳定性比A的强是因为其最简气态氢化物分子间存在氢键 | |
| B. | 由A元素构成的单质均具有熔点高、硬度大的特性 | |
| C. | 常温下E与D元素形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由A、B、C、D四种元素形成的化合物一定既有离子键,又有共价键 |
分析 A、B、C三种元素是原子序数依次递增的同周期元素,由A、B、C的最外层电子数之和为15,最外层电子数平均为5,A与C可形成AC2分子,A为+4价,C为-2价,可推出A、B、C分别为C、N、O三种元素;
根据B与D形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定D为H元素;
根据E的质子数是A、B、C、D四种元素质子数之和的$\frac{1}{2}$,推出E的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以E为Na元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:A、B、C三种元素是原子序数依次递增的同周期元素,由A、B、C的最外层电子数之和为15,最外层电子数平均为5,A与C可形成AC2分子,A为+4价,C为-2价,可推出A、B、C分别为C、N、O三种元素;
根据B与D形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定D为H元素;
根据E的质子数是A、B、C、D四种元素质子数之和的$\frac{1}{2}$,推出E的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以E为Na元素,
A.分子中共价键的键能越大,分子越稳定,N的最简气态氢化物的热稳定性比C的强是因为N-H的键能大于C-H的键能,故A错误;
B.X为C,形成的单质有金刚石、石墨、C60等,C60属于分子晶体熔点低、硬度小,故B错误;
C.常温下Na与H元素形成的化合物NaH,1molNaH与水完全反应生成1mol氢气,则气体的质量为2克,故C正确;
D.由A、B、C、D四种元素形成的化合物,如氨基酸中只有共价键,故D错误.
故选C.
点评 本题考查元素推断、元素周期律、分子结构及C、N、Na元素化合物性质等,侧重于学生的分析能力的考查,难度中等,根据密度判断B 与D 形成的气态化合物是氨气为推断的关键.

| A. | 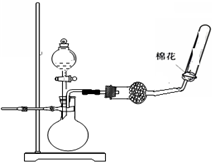 制取收集干燥氨气 | B. |  碳酸氢钠受热分解 | ||
| C. | 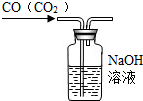 除去CO气体中的CO2气体 | D. | 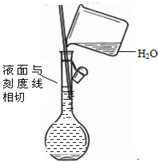 配制溶液 |
| A. | 52.2% | B. | 31.4% | C. | 30% | D. | 27.5% |
| A. | n-5 | B. | n+3 | C. | n+13 | D. | n-13 |
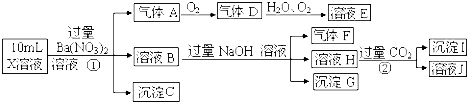
根据以上信息,下列观点正确的是( )
| A. | 沉淀G的化学式为Fe(OH)2 | |
| B. | 生成气体A的离子方程式为2Fe2++NO3-+4H+=2Fe3++NO↑+2H2O | |
| C. | 反应②中的离子方程式有AlO2-+CO2+2H2O=Al(OH)3+HCO3- | |
| D. | 溶液X中,除H+ 外还肯定含有的离子是NH4+、Fe2+、SO42-. |
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>H2SiO3
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |

| A. | 该有机物在一定条件下可以发生消去反应 | |
| B. | 1mol该有机物与足量的溴水反应时最多消耗4molBr2 | |
| C. | 该有机物不能使酸性高锰酸钾溶液褪色 | |
| D. | 该有机物在一定条件下可以发生水解反应和酯化反应 |
| A. | 硒元素的非金属性比溴元素的弱 | |
| B. | 硒的最高价氧化物的水化物的分子式为:H2SeO3 | |
| C. | 硒在周期表中位于第五周期VIA族 | |
| D. | 硒的气态氢化物的稳定性比硫化氢强 |
 (1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;
(1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;