题目内容
8.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):(1)A~F六种元素原子,原子半径最大的是Na;D、E、F形成的简单离子半径最大的是S2-.(以上均填微粒符号)
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:
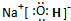 .
.(3)E、F分别形成的气态氢化物更稳定的是HCl(填化学式);
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为NCl3.B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:NCl5+3H2O═HNO3+5HCl.
(5)A、B、C三种元素形成的一种常见化合物,其浓溶液在常温下可与铜反应,该反应的离子方程式为:Cu+4H++2NO3-(浓)═Cu2++2NO2↑+2H2O.
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,化合物为水,则A为H元素,C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素,结合对应元素形成的单质、化合物的性质以及元素周期率知识解答该题.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,化合物为水,则A为H元素,C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素,
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大,所以Na原子半径最大,离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,则S2-半径最大,
故答案为:Na; S2-;
(2)A为H元素,C为O元素,D为Na元素,三元素形成的常见化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为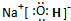 ,
,
故答案为: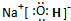 ;
;
(3)非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,则HCl较稳定,故答案为:HCl;
(4)B为N元素,F为Cl元素,两种元素形成的一种化合物分子,各原子均达8电子结构,应生成NCl3,如N显最高正价为+5价,两种元素形成的一种化合物是NCl5,其中N显+5、价,Cl显-1价,其水解的主要产物为HNO3和HCl,化学反应方程式为:NCl5+3H2O=5HCl+HNO3,
故答案为:NCl3;NCl5+3H2O═HNO3+5HCl;
(5)A、B、C三种元素形成的一种常见化合物,其浓溶液在常温下可与铜反应,应为硝酸与铜的反应,反应离子方程式为Cu+4H++2NO3-(浓)═Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-(浓)═Cu2++2NO2↑+2H2O.
点评 本题考查位置、结构、性质的关系及应用,综合性较强,考查知识点较多,元素的推断是解答本题的关键,A与C形成的化合物常温下为液态是推断突破口.并熟悉元素化合物的性质来解答,难度较大.

| A. | 47 | B. | 57 | C. | 61 | D. | 175 |

根据以上信息,下列观点正确的是( )
| A. | 沉淀G的化学式为Fe(OH)2 | |
| B. | 生成气体A的离子方程式为2Fe2++NO3-+4H+=2Fe3++NO↑+2H2O | |
| C. | 反应②中的离子方程式有AlO2-+CO2+2H2O=Al(OH)3+HCO3- | |
| D. | 溶液X中,除H+ 外还肯定含有的离子是NH4+、Fe2+、SO42-. |
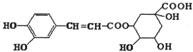
| A. | 该有机物在一定条件下可以发生消去反应 | |
| B. | 1mol该有机物与足量的溴水反应时最多消耗4molBr2 | |
| C. | 该有机物不能使酸性高锰酸钾溶液褪色 | |
| D. | 该有机物在一定条件下可以发生水解反应和酯化反应 |
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
| A. | 乙醇与甲醚 | B. | 麦芽糖与纤维二糖 | ||
| C. | 淀粉与纤维素 | D. | 2-甲基丁烷和戊烷 |
 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分. CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应.
CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应. .
. +4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+
+4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+ +2H2O.
+2H2O.