题目内容
10.下列物质的沸点由高到低排列的顺序是( )①CH3(CH2)2CH3;
②CH3(CH2)3CH3;
③(CH3)3CH;
④CH3CH2CH3;
⑤CH3(CH2)4CH3.
| A. | ⑤③①②④ | B. | ⑤②①③④ | C. | ⑤①③②④ | D. | ②⑤③①④ |
分析 这几种物质都是饱和烃,饱和烃中碳原子个数越多其熔沸点越高,碳原子个数相等的饱和烃,支链越少其熔沸点越高,据此判断熔沸点高低顺序.
解答 解:这几种物质都是饱和烃,饱和烃中碳原子个数越多其熔沸点越高,碳原子个数相等的饱和烃,支链越少其熔沸点越高,碳原子个数大小顺序是⑤>②>①>③>④,③中含有一个支链、①中不含支链,
所以熔沸点高低顺序是⑤②①③④,故选B.
点评 本题考查烷烃熔沸点高低顺序判断,明确碳原子数、支链数与熔沸点关系即可解答,熟悉常见有机物结构,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
6.25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
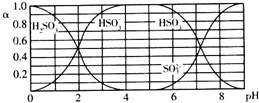

| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
1.下列烃中,一卤代物的同分异构体的数目最少和最多的分别是( )
| A. | 乙烷 | B. | 2-甲基丙烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
18.美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数为( )
| A. | 47 | B. | 57 | C. | 61 | D. | 175 |
5.室温下测得甲醛、乙醛和丙酮组成的液态混合物中氢元素的质量分数为9.8%,则该混合物的氧元素的质量分数为( )
| A. | 52.2% | B. | 31.4% | C. | 30% | D. | 27.5% |
15.化合物甲的结构简式为 ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: 、
、 和
和 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
 ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: 、
、 和
和 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )| A. |  | B. |  | ||
| C. |  | D. |  |
2.A、B是短周期元素,两元素能形成B2A型离子化合物,B离子比A离子少一个电子层,已知A的原子序数为n,则B的原子序数为( )
| A. | n-5 | B. | n+3 | C. | n+13 | D. | n-13 |
19.某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:

根据以上信息,下列观点正确的是( )

根据以上信息,下列观点正确的是( )
| A. | 沉淀G的化学式为Fe(OH)2 | |
| B. | 生成气体A的离子方程式为2Fe2++NO3-+4H+=2Fe3++NO↑+2H2O | |
| C. | 反应②中的离子方程式有AlO2-+CO2+2H2O=Al(OH)3+HCO3- | |
| D. | 溶液X中,除H+ 外还肯定含有的离子是NH4+、Fe2+、SO42-. |
20.下列各组物质不属于同分异构体的是( )
| A. | 乙醇与甲醚 | B. | 麦芽糖与纤维二糖 | ||
| C. | 淀粉与纤维素 | D. | 2-甲基丁烷和戊烷 |