题目内容
4.向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现血红色.那么,由此得出下列的结论错误的是( )| A. | 该晶体中一定含有SCN- | |
| B. | Fe3+的氧化性比Br2的氧化性强 | |
| C. | Fe2+被Br2氧化为Fe3+ | |
| D. | Fe2+ 与SCN-不能形成血红色的化合物 |
分析 向某晶体的水溶液中加入含Fe2+ 的溶液后,无明显变化,当滴加几滴溴水后,亚铁离子被溴氧化成铁离子,此时混合液出现血红色,证明原晶体中一定含有SCN-,铁离子与硫氰根离子反应生成血红色的硫氰化铁,而亚铁离子不能与硫氰根离子反应,据此进行解答.
解答 解:A.只有铁离子遇SCN-才能形成红色的化合物,所以晶体中一定含有SCN-,故A正确;
B.溴水氧化亚铁离子生成铁离子,溴是氧化剂,铁离子是氧化产物,故Br2的氧化性比Fe3+的氧化性强,故B错误;
C.溴的氧化性大于铁离子,亚铁离子能被溴氧化为铁离子,故C正确;
D.铁离子遇SCN-能形成红色的化合物,Fe2+与SCN-不能形成红色的化合物,故D正确;
故选B.
点评 本题考查铁离子、亚铁离子的检验方法,难度不大.注意掌握铁离子、亚铁离子的性质及常用的检验方法,如检验亚铁离子时,应该是先加入硫氰化钾溶液,然后再加入氧化剂,顺序不能颠倒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.表示对应化学反应的离子方程式正确的是( )
| A. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| B. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+═4Cr3++11H2O+3CH3COO- | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ |
15.化合物甲的结构简式为 ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: 、
、 和
和 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
 ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: 、
、 和
和 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )| A. |  | B. |  | ||
| C. |  | D. |  |
12.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 | |
| C. | iPhone6外壳易掉色是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| D. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
19.某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:

根据以上信息,下列观点正确的是( )

根据以上信息,下列观点正确的是( )
| A. | 沉淀G的化学式为Fe(OH)2 | |
| B. | 生成气体A的离子方程式为2Fe2++NO3-+4H+=2Fe3++NO↑+2H2O | |
| C. | 反应②中的离子方程式有AlO2-+CO2+2H2O=Al(OH)3+HCO3- | |
| D. | 溶液X中,除H+ 外还肯定含有的离子是NH4+、Fe2+、SO42-. |
9.以下说法正确的是( )
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 干冰升华破坏了共价键 | |
| C. | 共价化合物中一定不含离子键 | |
| D. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 |
13.一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,关于此电池的推断正确的是( )
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
14.元素周期表与原子结构、元素性质密切相关.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是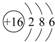 ;④的离子结构示意图
;④的离子结构示意图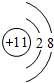 .
.
(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物: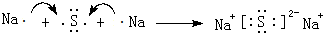 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在这些元素中,在最高价氧化物的水化物中,酸性最强的元素是Cl,碱性最强的元素是K.
(3)表中元素⑥的原子结构示意图是
 ;④的离子结构示意图
;④的离子结构示意图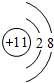 .
.(4)最高价氧化物的水化物显两性的化合物是Al(OH)3;写出它与④的氢氧化物水溶液反应的离子方程式Al(OH)3+OH-=AlO2-+H2O.
(5)用电子式表示:元素④与⑥形成的化合物:
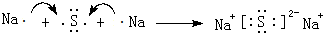 .
.  氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.