题目内容
20.化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热,等等.(1)下列△H表示物质燃烧热的是△H4,△H5;表示物质中和热的是△H6.(填△H1、△H2 和△H3等)
A.2H2(g)+O2(g)═2H2O(l)△H1;
B.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3;
D.C(s)+O2(g)═CO2(g)△H4;
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l);△H7
(2)2.00gC2H2气体完全燃烧生成液态水和CO2,放出99.6kJ的热量.写出该反应的热化学方程式:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1294.8 kJ/mol.
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与5mol/L100mL KOH溶液完全反应.求燃烧1mol丁烷放出的热量(设其数值为X)[8Q,16Q].
(4)碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径.甲烷是一种重要的清洁燃料,燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890KJ.mol-1;
请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量,反应为放热.或1mol CH4与2mol O2化学键的破坏需要吸收能量小于2CO mol与4 mol H2O化学键的形成要放出能量,反应为放热.
分析 (1)燃烧热指1mol物质完全燃烧生成稳定的氧化物的反应热,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和热指稀溶液中酸与碱反应生成1molH2O的反应热热量;
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,则1molC2H2气体气体完全燃烧放出的热量为$\frac{1mol×26g/mol}{2g}$×99.6kJ=1294.8kJ;
(3)CO2恰好与KOH溶液完全反应生成正盐为K2CO3或酸式盐KHCO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),n(KHCO3),根据碳元素守恒由n(CO2)=n(KHCO3)=n(K2CO3),进而计算丁烷的物质的量,据此计算反应放出热量;
(4)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,利用盖斯定律来分析;化学反应的实质是旧键的断裂和新键的生成.
解答 解:(1)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热,
B.碳燃烧的生成物为CO,表示温度的氧化物CO2,反应热△H2不能表示燃烧热,
C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热,
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热,
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热,
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热,
G.反应生成的水为2mol,反应热△H7不能表示中和热,
故答案为:△H4、△H5;△H6;
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,则1molC2H2气体气体完全燃烧放出的热量为$\frac{1mol×26g/mol}{2g}$×99.6kJ=1294.8kJ,故该反应的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol;
(3)KOH的物质的量为0.1L×5mol/L=0.5mol,若生成碳酸钾,根据钾离子守恒,故n(K2CO3)=0.5mol×$\frac{1}{2}$=0.25mol,根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,根据碳元素守恒可知,丁烷的物质的量为0.25mol×$\frac{1}{4}$=$\frac{1}{16}$mol,即$\frac{1}{16}$mol丁烷放出的热量大小为QkJ,故1mol丁烷完全燃烧放出的热量为QkJ×$\frac{1mol}{\frac{1}{16mol}}$=16QkJ,若生成碳酸氢钾,n(KHCO3)=0.5mol,根据碳元素守恒由n(CO2)=n(KHCO3)=0.5mol,丁烷的物质的量为0.5mol×$\frac{1}{4}$=$\frac{1}{8}$mol,放出的热量大小为QkJ,1mol丁烷完全燃烧放出的热量为QkJ×$\frac{1mol}{\frac{1}{8}mol}$=8QKJ,则燃烧1mol丁烷放出的热量[8Q,16Q]
故答案为:[8Q,16Q];
(4)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,已知:
①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
根据盖斯定律,将$\frac{①+②}{2}$可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=$\frac{(-1214KJ/mol)+(-566KJ/mol)}{2}$=-890KJ/mol,即甲烷的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol;
化学反应的实质是旧键的断裂和新键的生成,旧键的断裂吸收能量,新键的形成放出能量,反应放热是因为形成新键时放出的能量大于断裂旧键时吸收的能量,或1mol CH4与2mol O2化学键的破坏需要吸收能量小于2CO mol与4 mol H2O化学键的形成要放出能量,反应为放热;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890KJ.mol-1,化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量,反应为放热.或1mol CH4与2mol O2化学键的破坏需要吸收能量小于2CO mol与4 mol H2O化学键的形成要放出能量,反应为放热;
点评 本题考查燃烧热与中和热的概念、反应热的有关计算、热化学方程式的意义等,注意中和热与燃烧热概念的把握,题目难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案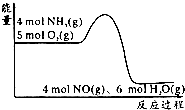 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )| A. | 由图可知a>0 | |
| B. | 升高温度可以提高NH3的转化率 | |
| C. | 反应体系中加入催化剂可增加反应热 | |
| D. | 将平衡混合物通入水中一定有硝酸铵生成 |
| A. | 用碳棒作电极电解饱和MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | FeO溶于足量稀HNO3中:FeO+2H+═Fe2++H2O | |
| C. | 向苯酚钠溶液中通人少量CO2气体: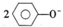 +CO2+H2O→ +CO2+H2O→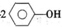 ↓+CO32- ↓+CO32- | |
| D. | 向AlCl3溶液中加入过量氨水Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | 80% | B. | 75% | C. | 60% | D. | 40% |
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
| A. | F2→F- | B. | HNO3→NO | C. | Mg→Mg2+ | D. | Na2O2→O2 |
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)化学性质最不活泼的元素是Ne(填元素符号).
(3)镁的原子结构示意图为
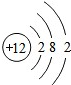 .
.(4)C与N相比,原子半径较小的是N.
(5)最高价氧化物对应的水化物酸性最强的是HClO4碱性最强的是NaOH(填化学式).
(6)常用于制半导体材料的元素是硅.
(7)H2S和HCl相比,热稳定性较强的是HCl.
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2,其中硫元素和氧元素的质量比m(S):m(O)=1:1.
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:2Na+2H2O=2NaOH+H2↑.