题目内容
5.实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是( )| A. | F2→F- | B. | HNO3→NO | C. | Mg→Mg2+ | D. | Na2O2→O2 |
分析 既不需要另加入还原剂,也不需要另加入氧化剂,说明可自身发生氧化还原反应,常见有氯气与水、碱以及过氧化钠与水、二氧化碳的反应,以此解答该题.
解答 解:A.F元素化合价降低,应加入还原剂,故A不选;
B.N元素化合价降低,应加入还原剂,故B不选;
C.Mg元素化合价升高,应加入氧化剂,故C不选;
D.可与水、二氧化碳反应生成氧气,过氧化钠自身发生氧化还原反应,故D选.
故选D.
点评 本题考查氧化还原反应,题目难度不大,注意常见物质的性质的掌握,把握氧化还原反应的相关概念的识别,从元素化合价变化的角度认识.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好使电解液恢复到电解前的浓度和pH(不考虑CO2的溶解).则电解过程中共转移电子的物质的量为( )
| A. | 0.1mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
16.下列说法正确的是( )
| A. | 0.03mol/L HA与0.03mol/L NaA等体积混合得到的碱性溶液中:c(Na+)>c(A--) | |
| B. | 酸性溶液中水的电离程度一定比纯水的电离程度小 | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液c(NaOH)<c(CH3COONa<c((Na2CO3 | |
| D. | 室温下,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后,pH大于7 |
13.下列物质中属于含有极性共价键的离子化合物的是( )
| A. | 过氧化钠 | B. | 碘化氢 | C. | 苛性钠 | D. | 氯化钾 |
10.进行简单类推的思维方法不一定都能得到正确结论,因此类推的结论最终要经过实践的检验才能决定其正确与否.下列几种类推结论中正确的是( )
| A. | 可电解熔融MgCl2来制取金属镁,也能电解熔融HCl来制取Cl2 | |
| B. | 卤族元素的单质从F2到I2的熔点逐渐升高,则碱金属元素单质从Li到Cs的熔点也逐渐升高 | |
| C. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序是HCl>H2S>PH3 | |
| D. | 少量的Cl2通入FeBr2溶液中生成FeCl3和FeBr3,则少量的Cl2通入FeI2 溶液中也生成FeCl3和FeI3 |
17.下列离子方程式不正确的是( )
| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
9.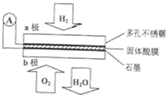 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1 mol电子,标准状况下需消耗1.12L的H2 |