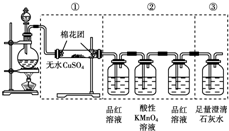
题目内容
11.下列离子方程式书写正确的是( )| A. | 用碳棒作电极电解饱和MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | FeO溶于足量稀HNO3中:FeO+2H+═Fe2++H2O | |
| C. | 向苯酚钠溶液中通人少量CO2气体: +CO2+H2O→ +CO2+H2O→ ↓+CO32- ↓+CO32- | |
| D. | 向AlCl3溶液中加入过量氨水Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.用碳棒作电极电解饱和MgCl2溶液生成氢氧化镁、氢气和氯气;
B.亚铁离子被稀硝酸氧化;
C.苯酚酸性比碳酸氢钠强,应生成苯酚和碳酸氢钠;
D.向AlCl3溶液中加入过量氨水生成氢氧化铝,氢氧化铝不溶于氨水.
解答 解:A.用碳棒作电极电解饱和MgCl2溶液生成氢氧化镁、氢气和氯气,反应的离子方程式为Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2↓+Cl2↑+H2↑,故A错误;
B.亚铁离子被稀硝酸氧化,离子方程式应为3FeO+10H++NO3-=3Fe3++NO+5H2O,故B错误;
C.苯酚酸性比碳酸氢钠强,应生成苯酚和碳酸氢钠,反应的离子方程式应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D.向AlCl3溶液中加入过量氨水生成氢氧化铝,氢氧化铝不溶于氨水,反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确.
故选D.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.已知几种短周期元素的原子半径、常见的最高价和最低价如下表:
请回答下列问题:
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物 (用电子式表示)
(用电子式表示)
(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式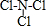 .
.
| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物
 (用电子式表示)
(用电子式表示)(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式
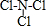 .
.
2.下列化学反应,能用离子方程式H++OH-=H2O表示的是( )
| A. | NaOH溶液和CO2反应 | B. | Cu(OH)2溶液和稀H2SO4反应 | ||
| C. | 氢氧化钡溶液和硝酸反应 | D. | 氨水和稀H2SO4反应 |
6.在元素周期表中,磷元素的某些信息如图所示.下列说法不正确的是( )
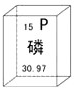

| A. | 磷元素为非金属元素 | B. | 磷原子核外有15个电子 | ||
| C. | 磷的原子序数为15 | D. | 相对原子质量为30.97g |
16.下列说法正确的是( )
| A. | 0.03mol/L HA与0.03mol/L NaA等体积混合得到的碱性溶液中:c(Na+)>c(A--) | |
| B. | 酸性溶液中水的电离程度一定比纯水的电离程度小 | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液c(NaOH)<c(CH3COONa<c((Na2CO3 | |
| D. | 室温下,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后,pH大于7 |
3.已知下列键能数据,则反应:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H为( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | 236 kJ•mol-1 | B. | -116 kJ•mol-1 | C. | -236 kJ•mol-1 | D. | 116 kJ•mol-1 |