题目内容
10.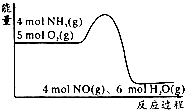 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )| A. | 由图可知a>0 | |
| B. | 升高温度可以提高NH3的转化率 | |
| C. | 反应体系中加入催化剂可增加反应热 | |
| D. | 将平衡混合物通入水中一定有硝酸铵生成 |
分析 A、图象分析反应物总能量大于生成物总能量;
B、图象分析反应是放热反应,升温平衡逆向进行;
C、催化剂只改变反应速率不改变化学平衡;
D、将平衡混合物通入水中NO、氧气和水反应生成硝酸,硝酸再与氨气反应生成硝酸铵.
解答 解:A、图象分析反应物总能量大于生成物总能量,则该反应是放热反应,所以a<0,故A错误;
B、图象分析判断反应是放热反应,升温平衡逆向进行,降低NH3的转化率,故B错误;
C、催化剂只改变反应速率不改变化学平衡,反应体系中加入催化剂不改变反应热,故C错误;
D、将平衡混合物通入水中NO、氧气和水反应生成硝酸,硝酸再与氨气反应生成硝酸铵,故D正确;
故选D.
点评 本题考查了化学平衡的影响因素分析判断,注意催化剂改变速率不改变平衡的理解,题目难度中等.

练习册系列答案
相关题目
1.已知几种短周期元素的原子半径、常见的最高价和最低价如下表:
请回答下列问题:
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物 (用电子式表示)
(用电子式表示)
(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式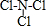 .
.
| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物
 (用电子式表示)
(用电子式表示)(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式
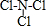 .
.
18.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3二丁烯 | B. | 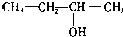 3-丁醇 | ||
| C. | 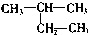 2-甲基丁烷 2-甲基丁烷 | D. | 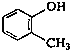 甲基苯酚 甲基苯酚 |
5.取浓度相等的NaOH和HCl溶液,以3:2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.05mol/L | D. | 0.50mol/L |
15.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好使电解液恢复到电解前的浓度和pH(不考虑CO2的溶解).则电解过程中共转移电子的物质的量为( )
| A. | 0.1mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
2.下列化学反应,能用离子方程式H++OH-=H2O表示的是( )
| A. | NaOH溶液和CO2反应 | B. | Cu(OH)2溶液和稀H2SO4反应 | ||
| C. | 氢氧化钡溶液和硝酸反应 | D. | 氨水和稀H2SO4反应 |