题目内容
15.在50mL FeCl3和CuCl2的混合溶液中,FeCl3和CuCl2的浓度均为1mol/L,在混合溶液中加入100mL NaOH溶液,恰好完全反应,则该NaOH溶液的浓度为( )| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
分析 FeCl3和CuCl2与NaOH反应生成氢氧化铁、氢氧化铜和氯化钠,恰好反应时混合液中溶质为NaCl,根据质量守恒,则一定满足:n(Cl-)=n(NaCl)=n(NaOH),根据氯化铁、氯化铜的浓度计算出氯离子总浓度,再计算出氯离子的物质的量,然后根据c=$\frac{n}{V}$计算出该氢氧化钠溶液的浓度.
解答 解:FeCl3和CuCl2的浓度均为1mol•L-1,则混合液中氯离子浓度为:1mol/L×3+1mol/L×2=5mol/L,
50mL混合液中含有的氯离子的物质的量为:n(Cl-)=5mol/L×0.05L=0.25mol,
FeCl3和CuCl2的混合液中加入NaOH溶液,恰好反应后生成NaCl溶液,根据质量守恒定律可知:n(Cl-)=n(NaCl)=n(NaOH),
所以氢氧化钠的物质的量为:n(NaOH)=n(Cl-)=0.25mol,
该氢氧化钠溶液的物质的量浓度为:c(NaOH)=$\frac{0.25mol}{0.1L}$=2.5mol/L,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握物质之间的反应原理,明确质量守恒在化学计算中的应用方法,本题中明确“n(Cl-)=n(NaCl)=n(NaOH)”可以大大简化计算步骤,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
5.取浓度相等的NaOH和HCl溶液,以3:2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.05mol/L | D. | 0.50mol/L |
6.在元素周期表中,磷元素的某些信息如图所示.下列说法不正确的是( )
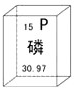

| A. | 磷元素为非金属元素 | B. | 磷原子核外有15个电子 | ||
| C. | 磷的原子序数为15 | D. | 相对原子质量为30.97g |
3.已知下列键能数据,则反应:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H为( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | 236 kJ•mol-1 | B. | -116 kJ•mol-1 | C. | -236 kJ•mol-1 | D. | 116 kJ•mol-1 |
10.下列说法或表示方法中正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 在25°C、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ量,则表示H2燃烧热的化学方程式 2H2(g)+O2(g)═2H2O(l)△H=-571kJ•mol-1 |
4.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L/、0.08mol/L,下列判断不合理的是( )
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
19.下列现象与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
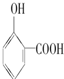
④尿素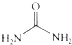 的熔、沸点比醋酸
的熔、沸点比醋酸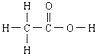 的高.
的高.
⑤晶体熔点的高低: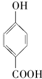 >
>
⑥水分子高温下很稳定.
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素
 的熔、沸点比醋酸
的熔、沸点比醋酸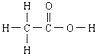 的高.
的高.⑤晶体熔点的高低:
 >
>
⑥水分子高温下很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
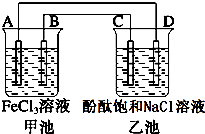 如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:
如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题: