题目内容
11. Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
分析 A.据沉淀的转化原理分析;
B.当c(C1-)=10-1 mol/L即pCl=1时,根据图象分析;
C.HgCl2是一种弱电解质,根据溶液中离子存在方式判断电解质电离方式;
D.根据图象可知当溶液pH保持在5,pCl由2改变至6时,根据图片中微粒存在方式判断;
解答 解:A.HgS比FeS更难溶于水,所以在含有Hg2+的溶液中加入FeS,能够将Hg2+除掉,故A正确;
B.当c(C1-)=10-1 mol/L即pCl=1时,汞元素主要是以HgCl42-形式存在,故B正确;
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3ˉ,故C错误;
D.根据图象可知当溶液pH保持在5,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,故D正确;
故选C.
点评 本题考查了溶解平衡的有关应用与判断等知识点,正确分析图象中曲线变化是解本题关键,再结合外界条件对平衡的影响等知识点来分析解答,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
2. 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有还原作用 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 每消耗3 mol H2O2,转移的电子为6 mol |
19.已知:CO2(g)+C(s)=2CO(g)△H1
C(s)+H2O(g)=CO(g)+H2(g)△H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3
CuO(s)+CO(g)=Cu(s)+CO2(g)△H4
2CuO(s)+C(s)=2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断不正确的是( )
C(s)+H2O(g)=CO(g)+H2(g)△H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3
CuO(s)+CO(g)=Cu(s)+CO2(g)△H4
2CuO(s)+C(s)=2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断不正确的是( )
| A. | △H1>0 | B. | △H2>0 | C. | △H2<△H3 | D. | △H5=2△H4+△H1 |
6.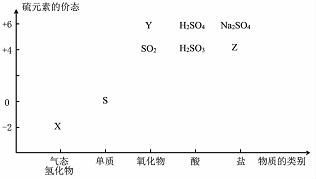 物质的类别和核心元素的化合价是研究物质性质的两个基本视角?
物质的类别和核心元素的化合价是研究物质性质的两个基本视角?
(1)图中X的电子式为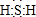 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?
(2)Na2S2O3是一种用途广泛的钠盐?
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是bd (填字母序号)?
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O?研究其反应速率时,下列说法正确的是b(填写字母序号)?
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度?温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO?SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体?
①已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1
则治理烟道气反应的热化学方程式为2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1?
②一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是cd (填写字母序号)?
a.v(CO):v(SO2)=2:1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$,则SO2的转化率为60%?
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇?甲醇可制作燃料电池?写出以氢氧化钾为电解质的甲醇燃料电池负极反应式CH3OH-6e-+8OH-=CO32-+6H2O?
(5)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表?
吸收CO2最合适的试剂是Ba(OH)2 (填“Ca(OH)2”或“Ba(OH)2”)溶液?
 物质的类别和核心元素的化合价是研究物质性质的两个基本视角?
物质的类别和核心元素的化合价是研究物质性质的两个基本视角?(1)图中X的电子式为
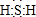 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱 (填“强”或“弱”)?用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱?(2)Na2S2O3是一种用途广泛的钠盐?
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是bd (填字母序号)?
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O?研究其反应速率时,下列说法正确的是b(填写字母序号)?
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度?温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO?SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体?
①已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1
则治理烟道气反应的热化学方程式为2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1?
②一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是cd (填写字母序号)?
a.v(CO):v(SO2)=2:1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$,则SO2的转化率为60%?
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇?甲醇可制作燃料电池?写出以氢氧化钾为电解质的甲醇燃料电池负极反应式CH3OH-6e-+8OH-=CO32-+6H2O?
(5)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表?
| 溶解度(s)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
16.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~18元素中,满足上述关系的元素共有( )
| A. | 3对 | B. | 4对 | C. | 5对 | D. | 6对 |
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温下,0.05 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA | |
| B. | 标准状况下,22.4 L甲苯中含C-H数目为8NA | |
| C. | 常温常压下,3.2 g O2和O3混合物中,氧原子的数目为0.2NA | |
| D. | 0.1 mol Na2O2与足量CO2反应时,转移的电子数目为0.2NA |
7.下列描述的一定是金属元素的是( )
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
