题目内容
2.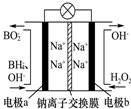 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有还原作用 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 每消耗3 mol H2O2,转移的电子为6 mol |
分析 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和解答该题.
解答 解:A.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故A正确;
B.电极b采用MnO2,为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,故B错误;
C.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.正极电极反应式为H2O2+2e-=2OH-,每消耗3molH2O2,转移的电子为6mol,故D正确;
故选B.
点评 本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意化合价的变化.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 除去苯中混有的少量苯酚,加入适量NaOH溶液,振荡、静置后分液 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,有沉淀产生,加水,沉淀重新溶解 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
10.下列反应I和反应II属于同一种反应类型的是( )
| 选项 | 反应Ⅰ | 反应Ⅱ |
| A | 甲烷与氯气在光照下生产一氯甲烷 | 乙烯与溴的四氯化碳溶液反应 |
| B | 乙醇催化氧化生成乙醛 | 由淀粉得到葡萄糖 |
| C | 由油脂得到甘油 | 乙烯制备聚乙烯 |
| D | 苯与浓硫酸浓硝酸反应生成硝基苯 | 乙醇和乙酸反应制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
17.X、Y、Z、W为四种短周期元素.已知X、Y的原子得到两个电子形成稀有气体原子结构时,X放出的能量大于Y.Z、W的原子失去一个电子形成稀有气体原子结构时,W吸收的能量大于Z.则下列关于四种元素的说法正确的是( )
| A. | W、X两元素对应的单质发生反应只能得到W2X | |
| B. | 由X、Y、Z三种元素组成的物质其水溶液一定呈中性 | |
| C. | 1 mol Z2X2与足量水反应可得气体11.2 L | |
| D. | 四种元素在自然界中均以化合态存在 |
7.下表是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是( )
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |
14.利用如图所示装置进行实验,通入Cl2前装置Ⅰ中溶液呈红色.下列说法不合理的是( )

| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 通入Cl2后,装置Ⅰ中溶液不褪色 | |
| D. | 装置Ⅱ的作用是吸收尾气,防止污染空气 |
11.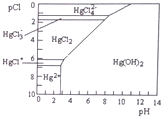 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
 X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大.X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素.Z元素形成的一种化合物常用作净水剂.W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl.请回答下列问题:
X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大.X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素.Z元素形成的一种化合物常用作净水剂.W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl.请回答下列问题: