题目内容
1.海水中含有丰富的溴,从海水中提取溴的工艺流程如下:
请回答下列问题:
(1)从盐碱湖中取食盐和纯碱,有“夏晒盐,冬天捞碱”之说,其原理是纯碱的溶解度受温度影响大,冬天温度低,纯碱易析出;食盐溶解度受温度影响不大,夏天温度高,水分易蒸发,食盐易析出;
(2)如果直接萃取操作Ⅰ的溴溶液获取粗溴,后果是获得的溴产量较低、成本较高,操作Ⅰ通常需要用稀硫酸酸化,其目的是提供氢离子,使溴化钠和溴酸钠在酸性条件下生成溴单质;
(3)工业上,利用热气体X将溶液中的溴单质吹出,X可能是空气,利用溴单质的性质是挥发性(填“氧化性”“还原性”“挥发性”或“腐蚀性”);
(4)用纯碱溶液吸收溴蒸气的离子方程式为3Br2+3CO32-=5Br-+BrO3-+3CO2↑;
(5)粗溴中含少量氯气,用离子方程式表示溴化钠的作用:Cl2+2Br-=2Cl-+Br2;
(6)已知氧化性:BrO3->Cl2,操作2中,如果用浓盐酸代替硫酸,其后果可能是溴酸钠将Cl-氧化为氯气,影响生成溴的纯度.
分析 (1)纯碱的溶解度随温度的降低而减小,且受温度的影响较大,冬天纯碱的溶解度较小,容易析出;氯化钠的溶解度收温度的影响较小,夏天温度较高,随着水分的很快蒸发,氯化钠从溶液中结晶析出;
(2)操作1获得的溴的溶液中浓度降低,会大大提高生成成本;操作2中用稀硫酸酸化后,溴离子和溴酸根离子在酸性条件下转化成溴单质;
(3)溴具有挥发性,可以用热的空气从溶液中吹出溴单质;
(4)碳酸钠与溴单质反应生成溴化钠、溴酸钠和水,据此写出反应的了离子方程式;
(5)氯气氧化性大于溴单质,溴离子能够与氯气反应从而除去氯气;
(6)氧化性BrO3->Cl2,BrO3-可氧化Cl-.
解答 解:(1)纯碱的溶解度随温度的降低而减小,且受温度的影响较大,所以冬天时纯碱的溶解度很小,会有很多的纯碱晶体从湖中结晶析出,所以冬天捞碱;夏天时,温度高,纯碱的溶解度变得很大,而氯化钠的溶解度几乎不变,随着水分的很快蒸发,氯化钠就会从溶液中结晶析出,
故答案为:纯碱的溶解度受温度影响大,冬天温度低,纯碱易析出;食盐溶解度受温度影响不大,夏天温度高,水分易蒸发,食盐易析出;
(2)操作1的溶液组成有水、液溴还有含有氯离子的盐等成分,溴单质的浓度较小,如果直接,萃取操作1的溴溶液获取粗溴,会导致获得溴产量低、成本高;操作2中稀硫酸提供氢离子,使溴化钠和溴酸钠在酸性条件下生成溴单质,
故答案为:获得的溴产量较低、成本较高;提供氢离子,使溴化钠和溴酸钠在酸性条件下生成溴单质;
(3)根据溴单质的挥发性,工业上利用热空气将溶液中的溴单质吹出,故答案为:空气;挥发性;
(4)碳酸钠与溴单质反应生成溴化钠、溴酸钠和水,反应的离子方程式为:3Br2+3CO32-=5Br-+BrO3-+3CO2↑,故答案为:3Br2+3CO32-=5Br-+BrO3-+3CO2↑;
(5)氯气能够与溴离子反应生成溴单质,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(6)由于氧化性:BrO3->Cl2,BrO3-可氧化Cl-,操作2中,如果用浓盐酸代替硫酸,溴酸钠会将Cl-氧化为氯气,影响生成溴的纯度,
故答案为:溴酸钠将Cl-氧化为氯气,影响生成溴的纯度.
点评 本题考查了海水资源的综合应用、制备实验方案的设计与评价,题目难度中等,明确制备原理及化学实验基本操作方法为解答关键,注意掌握物质制备方案的设计原则,试题侧重考查学生的分析、理解能力及化学实验能力.

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案| A. | 食盐 | B. | 蔗糖 | C. | 白醋 | D. | 面粉 |
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 除去苯中混有的少量苯酚,加入适量NaOH溶液,振荡、静置后分液 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,有沉淀产生,加水,沉淀重新溶解 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种方法即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较.
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.请解释化学反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢.请计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字).
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a.MnO2的质量有没有改变;b.MnO2的化学性质有没有改变.

| 选项 | 反应Ⅰ | 反应Ⅱ |
| A | 甲烷与氯气在光照下生产一氯甲烷 | 乙烯与溴的四氯化碳溶液反应 |
| B | 乙醇催化氧化生成乙醛 | 由淀粉得到葡萄糖 |
| C | 由油脂得到甘油 | 乙烯制备聚乙烯 |
| D | 苯与浓硫酸浓硝酸反应生成硝基苯 | 乙醇和乙酸反应制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |

 ;反应③
;反应③ .
.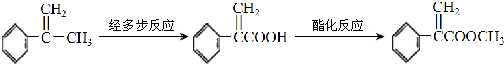

 X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大.X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素.Z元素形成的一种化合物常用作净水剂.W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl.请回答下列问题:
X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大.X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素.Z元素形成的一种化合物常用作净水剂.W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl.请回答下列问题: